Химическая энциклопедия
"ЭФИРЫ СЛОЖНЫЕ"
Главная - Химическая энциклопедия - буква Э - ЭФИРЫ СЛОЖНЫЕ
ЭФИРЫ СЛОЖНЫЕ , продукты замещения атомов водорода групп ОН в минер. или карбоновых к-тах на углеводородные радикалы. Для многоосновных к-т различают полные и кислые эфиры (напр., ROSO2OR и ROSO2OH, ROCOCH2COOR и ROCOCH2COOH соотв., где R, R - алкил, арил, гетерил). Строение Э. с. может быть представлено двумя резонансными структурами:
Эфирная группировка планарна или близка
к планарной: простая связь С — О (структура I) имеет конформацию с цисоидным
расположением карбонильной двойной связи и связи О — R. Длина связи С =
О в разл. Э. с. 0,119-0,122 нм, связи С — О 0,131-0,136 нм, углы ОСО 122-126°,
СОС 113-118°.
Физические свойства. Э. с. низших
карбоновых к-т и простейших спиртов - бесцв. летучие жидкости, часто с
приятным фруктовым запахом; Э. с. высших карбоновых к-т - твердые бесцв.
в-ва, почти лишенные запаха. Низшие Э. с. минер. к-т (алкилсульфиты, алкилсульфаты,
алкилбораты) - маслянистые жидкости с приятным запахом; алкилсульфаты,
начиная с С9Н17,- твердые соед. Т-ры кипения Э. с.
низших спиртов ниже, чем соответствующих к-т; т-ры кипения сульфитов обычно
ниже, чем сульфатов. Э. с. плохо раств. в воде, хорошо - в орг. р-рителях,
обладают значит. дипольным моментом ( Химические свойства. Большинство р-ций Э. с. связано с нуклеоф. атакой по карбонильному атому углерода и замещением алкоксигруппы:
Гидролиз Э. с. протекает как в кислой (минер.
к-ты), так и в щелочной среде [водные или спиртовые р-ры NaOH, КОН, а также
Ва(ОН)2, Са(ОН)2]:
Кислотный гидролиз - обратимый процесс,
щелочной -практически необратим, т. к. карбоксилат-анион RCOO-
не м. б. атакован нуклеофилом. Скорость гидролиза увеличивается с повышением
т-ры и с увеличением мол. массы эфира. Многие Э. с. (гл. обр. жиры) гидролизуются
под действием ферментов.
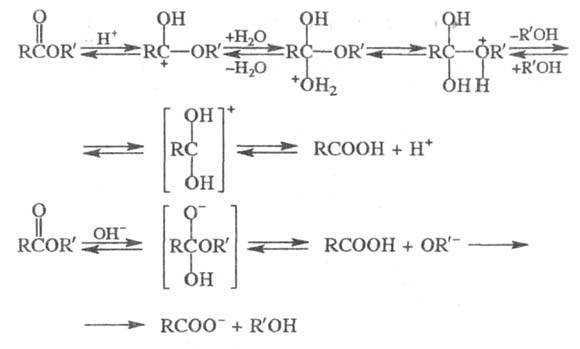
Особенно легко протекает внутримол. аминолиз;
напр.,
При взаимод. Э. с. с NH2OH образуются
гидроксамовые к-ты RCONHOH, с гидразином - гидразиды RCONHNH2,
с ацеталями или карбоновыми к-тами в присут. минер, к-т происходит обменная
р-ция (см. Ацидолиз
).
Э. с. вступают в сложноэфирную конденсацию
с соед., содержащими активную метиленовую группу (см. Клайзена конденсация
),
диэфиры двухосновных к-т претерпевают внутримол. конденсацию (см. Дикмана реакция
).
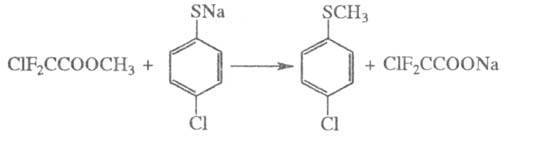
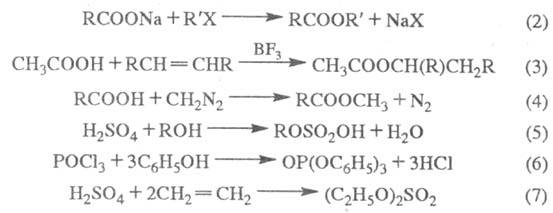
Э. с. минер. и фторзамещенных карбоновых к-т алкилируют разл. соед. в щелочной среде, напр.:
При т-ре выше 300 °С Э. с. разлагаются с образованием алкенов, пиролиз ацетатов проводят в газовой фазе при 500-600 °С:
Пиролиз Э. с. жирных к-т в присут. нек-рых металлов (Mg, Zn) или их оксидов приводит к кетонам:
Бензоаты и оксалаты разлагаются при более
низких т-рах в жидкой фазе.
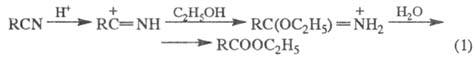
Получение. Наиб. широко применяют
этерификацию - взаимод. спиртов с к-тами: RCOOH + ROH
Равновесие смещают вправо путем отгонки
более летучих спирта, к-ты или эфира. Метод используют для получения Э.
с., к-рые нельзя получить этерификацией, напр. виниловые или изопропиловые
эфиры высших к-т.
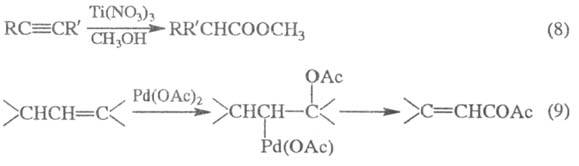
Для получения Э. с. используют окисление: кетонов Н2О2 или надкислотами (Байера-Виллигера реакция ), ацетиленовых производных (8), соед., содержащих аллильную группу (9) и др.:
Э. с. высших дикарбоновых к-т получают из солей кислых эфиров дикарбоновых к-т в условиях электрохим. р-ции Кольбе: 2ROOC(CH2)nCOONa Э. с. серной и фосфорной к-т образуются при окислении соответствующих сульфитов и фосфитов. Определение. Для обнаружения Э. с. используют их р-цию с гидроксиламином: образующиеся гидроксамовые к-ты дают с FеС13 характерное красное окрашивание, для определения -кислотное число и эфирное число, а также методы хроматографии. Применение. Э. с.- р-рители, пластификаторы,
экстрагенты, лек. средства (напр., нитроглицерин), сырье для синтеза полимеров
(напр., метилметакрилат) и фармацевтич. препаратов (напр., производных
салициловой к-ты). Э. с. серной к-ты используют как алкилирующие агенты;
Э. с. фосфорной к-ты - инсектициды, флотореагенты, присадки к маслам; низшие
Э. с. карбоновых к-т применяют в парфюмерии и пищ. пром-сти.
Лит.: Вейганд-Хильгетаг, Методы эксперимента в органической химии, пер. с нем., М., 1968; Общая органическая химия, пер. с англ., т. 4, М., 1983, с. 288-388; Kirk-Othmer encyclopedia, 3 ed., v. 9, N. Y., 1980, p. 311-37. Л. Н. Максимова.
|
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: ЭФИРЫ СЛОЖНЫЕ
будет выглядеть так: Что такое ЭФИРЫ СЛОЖНЫЕ

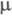 5,67 х 10-30-6,66 х 10-30 Кл х м).
5,67 х 10-30-6,66 х 10-30 Кл х м).
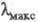 195-210 нм
195-210 нм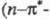 переход); для
переход); для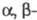 ненасыщ.
эфиров сильные полосы при
ненасыщ.
эфиров сильные полосы при 210 нм
210 нм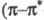 -переход),
по мере увеличения ненасыщенности полоса сдвигается в длинноволновую область.
В спектрах ПМР хим. сдвиг
-переход),
по мере увеличения ненасыщенности полоса сдвигается в длинноволновую область.
В спектрах ПМР хим. сдвиг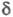 3,7-4,1 м. д. (
3,7-4,1 м. д. (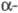 Н-атом
спиртового остатка) и
Н-атом
спиртового остатка) и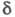 2-2,2 м. д. (
2-2,2 м. д. (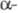 Н-атом
кислотного остатка).
Н-атом
кислотного остатка).
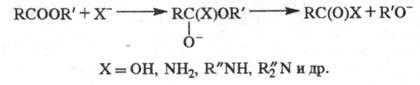
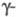 аминоэфиры
циклизуются уже при комнатной т-ре, давая пирролидоны:
аминоэфиры
циклизуются уже при комнатной т-ре, давая пирролидоны:

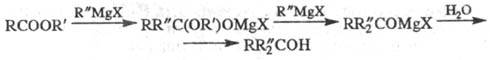
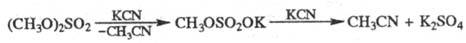
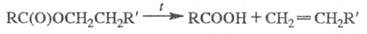
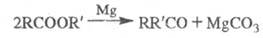
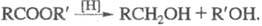 Каталитич. гидрирование Э. с. в присут. хромата (III) меди при т-ре 200-300
°С и давлении 10-30 МПа - пром. способ получения спиртов. При восстановлении
эфиров алифатич. моно- и дикарбоновых к-т Na в кипящем ксилоле образуются
ацилоины (см.
Каталитич. гидрирование Э. с. в присут. хромата (III) меди при т-ре 200-300
°С и давлении 10-30 МПа - пром. способ получения спиртов. При восстановлении
эфиров алифатич. моно- и дикарбоновых к-т Na в кипящем ксилоле образуются
ацилоины (см.  RCOOR
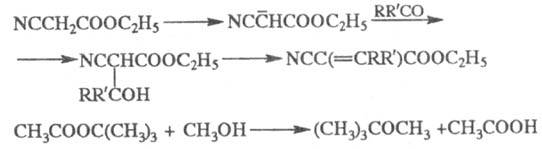
+ H2O. Это - обратимая р-ция, в к-рой положение равновесия зависит
от природы и кол-ва к-ты и спирта и характеризуется равновесной концентрацией
продуктов этерификации (т. наз. предел этерификации), напр. при эквимол.
соотношении СН3СООН и C2H5OH равновесие
устанавливается, когда ~2/3 к-ты и спирта превращается
в эфир. На скорость достижения предела этерификации влияют т-ра и катализаторы
(сильные к-ты и их ангидриды, арилсульфоновые к-ты, кислые соли и кислые
катионообменные смолы). Для повышения выхода воду из реакц. среды удаляют
азеотропной дистилляцией. Легче всего этерифицируются первичные спирты,
наиб. трудно - третичные.
RCOOR
+ H2O. Это - обратимая р-ция, в к-рой положение равновесия зависит
от природы и кол-ва к-ты и спирта и характеризуется равновесной концентрацией
продуктов этерификации (т. наз. предел этерификации), напр. при эквимол.
соотношении СН3СООН и C2H5OH равновесие
устанавливается, когда ~2/3 к-ты и спирта превращается
в эфир. На скорость достижения предела этерификации влияют т-ра и катализаторы
(сильные к-ты и их ангидриды, арилсульфоновые к-ты, кислые соли и кислые
катионообменные смолы). Для повышения выхода воду из реакц. среды удаляют
азеотропной дистилляцией. Легче всего этерифицируются первичные спирты,
наиб. трудно - третичные.
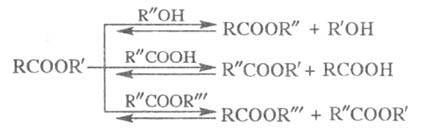
 ROOC(CH2)2nCOOR
ROOC(CH2)2nCOOR