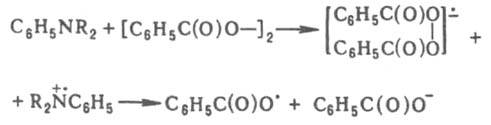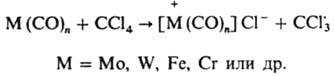Химическая энциклопедия
"ИНИЦИАТОРЫ РАДИКАЛЬНЫЕ"
Главная - Химическая энциклопедия - буква И - ИНИЦИАТОРЫ РАДИКАЛЬНЫЕ
ИНИЦИАТОРЫ РАДИКАЛЬНЫЕ
(от позднелат. initiator -зачинатель), в-ва, способные зарождать (инициировать) цепные радикальные процессы в результате распада или др. хим. р-ций образования радикалов свободных
. К таким процессам относятся, напр., радикальная полимеризация, окисление орг. соединений, радикально-цепное хлорирование и сульфохлорирование, теломеризация, структурирование полимеров. Иногда термин "инициатор" используют для обозначения в-в, возбуждающих ионную полимеризацию, если они необратимо расходуются на стадии инициирования (см. Катализаторы полимеризации
).
В качестве И. р. на практике чаще всего используют орг. и неорг. пероксиды, азосоединения, N-нитрозоанилиды, триазены, элементоорг. соед. (в т.ч. карбонилы металлов), дибензилы. Концентрация И. р. в среднем составляет 10-2 моль/л; при инициировании, напр., полимеризации метилметакрилата 2,2-азо-бис-изобутиронитрилом она равна 10-3 — 5.10-1 моль/л, а бензоилпероксидом - 5.10-4 —10-1 моль/л, при инициировании полимеризации стирола бензоилпероксидом -10-4-2.10-1 моль/л.
Орг. пероксиды и азосоединения - наиб. распространенные И. р., из них в пром-сти широко применяют бензоилпероксид
, трет-бутилгидропероксид
, трет-бутилпероксид
, кумилгидропероксид
, кумилпероксид
, 2,2-азо-бис-изобутиронитрил; из неорг. пероксидов наиб. важен водорода пероксид
, из элементоорганических ацетилциклогексилсульфонилпероксид C6H11SO2OOC(O)CH3 и три-(трет
-бутилперокси)винилкремний (C4H9OO)3SiCH=CH2. В нек-рых процессах И. р. может служить О2. Своб. радикалы в большинстве случаев генерируются в результате термич. или фотохим. распада И. р. или при окислит.-восстановит. р-циях. О генерировании радикалов путем фотолиза см. Фотохимические реакции
.
Пероксиды, азосоединения и дибензилы типа [С6Н5С(СН3)2-]2, [С6Н5С(СН3)(С2Н5)-]2 и [п-CH3OC6H4C(OC2H5)(CN)—]2, содержащие слабые связи соотв. О—О, С—N и С—С, используют для термич. генерирования своб. радикалов. При термолизе у пероксидов, как правило, первоначально гомолитически разрывается связь О—О (энергия активации Еакт = 115-170 кДж/моль), у азосоединений - обе связи С—N и выделяется N2 (Eакт = 110-145 кДж/моль). Распад при нагр., напр., N-нитрозоанилидов и триазенов происходит соотв. по ур-ниям:
|
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: ИНИЦИАТОРЫ РАДИКАЛЬНЫЕ
будет выглядеть так: Что такое ИНИЦИАТОРЫ РАДИКАЛЬНЫЕ
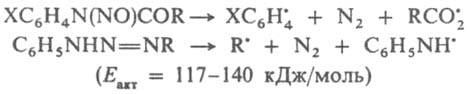
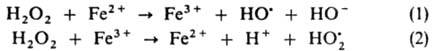
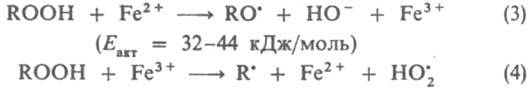
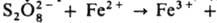
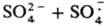 (Еакт = 50,7 кДж/моль).
В системах, содержащих бензоилперокрид или др. пероксиды ацилов в сочетании с диалкиланилином, перенос электрона осуществляется через промежуточный комплекс с образованием ион-радикальной пары по реакции:
(Еакт = 50,7 кДж/моль).
В системах, содержащих бензоилперокрид или др. пероксиды ацилов в сочетании с диалкиланилином, перенос электрона осуществляется через промежуточный комплекс с образованием ион-радикальной пары по реакции: