КИСЛОРОД
(лат Oxygenium, от греч. oxys кислый и gennao - рождаю) О, хим. элемент VI гр. периодич. системы, ат. н. 8, ат. м. 15,9994. Прир. К. состоит из трех стабильных изотопов: 16О (99,759%), 17О (0,037%) и 18О (0,204%]. Конфигурация внеш. электронной оболочки атома 2s22p; энергии ионизации О°:О+:О2+ равны соотв. 13,61819, 35,118 эВ; электроотрицательность по Полингу 3,5 (наиб. электроотрицат. элемент после F); сродство к электрону 1,467 эВ; ковалентный радиус 0,066 нм.
Молекула К. двухатомна. Существует также аллотропная модификация К. озон
О3. Межатомное расстояние в молекуле О2 0,12074 нм; энергия ионизации О2 12,075 эВ;
сродство к электрону 0,44 эВ; энергия диссоциации 493,57 кДж/моль, константа диссоциации Кр=pO2/pO2 составляет 1,662.10-1 при 1500 К, 1,264.10-2 при 3000 К, 48,37 при 5000 К; ионный радиус О2 (в скобках указаны координац. числа) 0,121 нм (2), 0,124 нм (4), 0,126 нм (6) и 0,128 нм (8).
В основном состоянии (триплетное 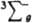 ) два валентных электрона молекулы О2, находящиеся на разрыхляющих орбиталях pх и pу, не спарены, благодаря чему К. парамагнитен (единств, парамагнитный газ, состоящий из гомоядерных двухатомных молекул); молярная магн. восприимчивость для газа 3,4400.10 (293 К), изменяется обратно пропорционально абс. т-ре (закон Кюри). Существуют два долгоживущих возбужденных состояния О2 - синглетное 1Dg (энергия возбуждения 94,1 кДж/моль, время жизни 45 мин) и синглетное ) два валентных электрона молекулы О2, находящиеся на разрыхляющих орбиталях pх и pу, не спарены, благодаря чему К. парамагнитен (единств, парамагнитный газ, состоящий из гомоядерных двухатомных молекул); молярная магн. восприимчивость для газа 3,4400.10 (293 К), изменяется обратно пропорционально абс. т-ре (закон Кюри). Существуют два долгоживущих возбужденных состояния О2 - синглетное 1Dg (энергия возбуждения 94,1 кДж/моль, время жизни 45 мин) и синглетное 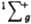 (энергия возбуждения 156,8 кДж/моль).
К.-наиб. распространенный элемент на Земле. В атмосфере содержится 23,10% по массе (20,95% по объему) своб. К., в гидросфере и литосфере - соотв. 85,82 и 47% по массе связанного К. Известно более 1400 минералов, в состав к-рых входит К. Убыль К. в атмосфере в результате окисления, в т. ч. горения, гниения и дыхания, возмещается выделением К. растениями при фотосинтезе. К. входит в состав всех в-в, из к-рых построены живые организмы; в организме человека его содержится ок. 65%.
Свойства. К.-бесцв. газ без запаха и вкуса. Т. кип. 90,188 К, т-ра тройной точки 54,361 К; плотн. при 273 К и нормальном давлении 1,42897 г/л, плотн. (в кг/м3) при 300 К: 6,43 (0,5 МПа), 12,91 (1 МПа), 52,51 (4 МПа); tкрит 154,581 К, ркрит 5.043 МПа, dкрит 436,2 кг/м3; С0p 29,4 Дж/(моль.К); DH0исп 6,8 кДж/моль (90,1 К); SO299 205,0 ДжДмоль.К); ур-ние температурной зависимости давления пара: в интервале 54-150 К lgp(гПа)=7,1648-377,153/T; теплопроводность 0,02465 Вт/(м.К) при 273 К; h 205,23 10-7 Па.с (298 К).
Жидкий К. окрашен в голубой цвет; плотн. 1,14 г/см3 (90,188 К); COp 54,40 Дж/(моль.К); теплопроводность 0,147 ВтДм.К) (90 К, 0,1 МПа); h 1,890.10-2 Па.с; g 13,2.10-5 Н/м (90 К), ур-ние температурной зависимости g=-38,46.10-3(1 - T/154,576)11/9 Н/м; nD 1,2149 (l=546,1 нм; 100 К); неэлектропроводен; молярная магн. восприимчивость 7,699.10-3 (90,1 К).
Твердый К. существует в неск. кристаллич. модификациях. Ниже 23,89 К устойчива а-форма с объемноцентрир. ром-бич, решеткой (при 21 К и 0,1 МПа а = 0,55 нм, b= 0,382 нм, с=0,344 нм, плотн. 1,46 г/см3), при 23,89-43,8 К-b-форма с гексаген, кристаллич. решеткой (при 28 К и 0,1 МПа а = 0,3307 нм, с = 1,1254 нм), выше 43,8 К существует g-форма с кубич. решеткой (а = 0,683 нм); DH° полиморфных переходов g:b 744 Дж/моль (43,818 К), b:a 93,8 Дж/моль (23,878 К); тройная точка b-g-газообразный К.: т-ра 283 К, давление 5,0 ГПа; DHOпл 443 Дж/молъ; ур-ние температурной зависимости плотности d=1,5154-0,004220T г/см3 (44 54 К), a-, b- и g- О2 кристаллы светло-синего цвета. Модификация р антиферромагнитна, a и g парамагнитны, их магн. восприимчивость соотв. 1,760.10-3 (23,7 К) и 1,0200.10-5 (54,3 К). При 298 К и повышении давления до 5,9 ГПа К. кристаллизуется, образуя окрашенную в розовый цвет гексаген. b-форму (а = 0,2849 нм, с = 1,0232 нм), а при повышении давления до 9 ГПа оранжевую ромбич. e-форму (при 9,6 ГПа а=0,42151 нм, b=0,29567 нм, с=0,66897 нм, плотн. 2,548 г/см3).
Р-римость К. при атм. давлении и 293 К (в см3/см3): в воде 0,031, этаноле 0,2201, метаноле 0,2557, ацетоне 0,2313; р-римость в воде при 373 К 0,017 см3/см3; р-римость при 274 К (в % по объему): в перфторбутилтетрагидрофуране 48,5, перфтордекалине 45,0, перфтор-l-метилдекалине 42,3. Хорошие твердые поглотители К. платиновая чернь и активный древесный уголь. Благородные металлы в расплавл. состоянии поглощают значит. кол-ва К., напр. при 960 °С один объем серебра поглощает ~22 объема К., к-рый при
охлаждении почти полностью выделяется. Способностью поглощать К. обладают мн. твердые металлы и оксиды, при этом образуются нестехиометрич. соединения.
К. отличается высокой хим. активностью, образуя соед. со всеми элементами, кроме Не, Ne и Аr. Атом К. в хим. соед. обычно приобретает электроны и имеет отрицат. эффективный заряд. Соед., в к-рых электроны оттягиваются от атома К., крайне редки (напр., OF2). С простыми в-вами, кроме Au, Pt, Xe и Кr, К. реагирует непосредственно при обычных условиях или при нагр., а также в присут. катализаторов. Р-ции с галогенами проходят под действием электрич. разряда или УФ излучения. В р-циях со всеми простыми в-вами, кроме F2, К. является окислителем.
Мол. К. образует три разл. ионные формы, каждая из к-рых дает начало классу соед.: О-2 - супероксидам, О22- - пeроксидам (см. Пероксидные соединения неорганические
, Пе-роксидные соединения органические), О+2 - диоксигенильным соeдинениям
. Озон образует озониды, в к-рых ионная форма К.-О-3. Молекула О2 присоединяется как слабый лиганд к нек-рым комплексам Fe, Co, Мn, Сu. Среди таких соед. важное значение имеет гемоглобин, к-рый осуществляет перенос К. в организме теплокровных.
Р-ции с К., сопровождающиеся интенсивным выделением энeргии, наз. горением
. Большую роль играют взаимод. К. с металлами в присут. влаги-атм. коррозия металлов
, а также дыхание
живых организмов и гниение. В результате гниения сложные орг. в-ва погибших животных и растений превращаются в более простые и в конечном счете в СО2 и волу.
С водородом К. реагирует с образованием воды и выделением большого кол-ва тепла (286 кДж на моль Н2). При комнатной т-ре р-ция идет крайне медленно, в присут. катализаторов - сравнительно быстро уже при 80-100 °С (эту р-цию используют для очистки Н2 и инертных газов от примеси О2). Выше 550 °С р-ция Н2 с О2 сопровождается взрывом.
Из элементов I гр. наиб. легко реагируют с К. Rb и Cs, к-рые самовоспламеняются на воздухе, К, Na и Li реагируют с К. медленнее, р-ция ускоряется в присут. паров воды. При сжигании щелочных металлов (кроме Li) в атмосфере К. образуются пероксиды М2О2 и супероксиды МО2. С элементами подгруппы IIа К. реагирует сравнительно легко, напр., Ва способен воспламеняться на воздухе при 20-25°С, Mg и Be воспламеняются выше 500 °С; продукты р-ции в этих случаях - оксиды и пероксиды. С элементами подгруппы IIб К. взаимод. с большим трудом, р-ция К. с Zn, Cd и Hg происходит только при более высоких т-рах (известны породы, в к-рых Hg содержится в элементарной форме). На пов-стях Zn и Cd образуются прочные пленки их оксидов, предохраняющие металлы от дальнейшего окисления.
Элементы III гр. реагируют с К. только при нагр., образуя оксиды. Компактные металлы Ti, Zr, Hf устойчивы к действию К. С углеродом К. реагирует с образованием СО2 и выделением тепла (394 кДж/моль); с аморфным углеродом р-ция протекает при небольшом нагревании, с алмазом и графитом - выше 700 °С.
С азотом К. реагирует лишь выше 1200°С с образованием NO, к-рый далее легко окисляется К. до NO2 уже при комнатной т-ре. Белый фосфор склонен к самовозгоранию на воздухе при комнатной т-ре.
Элементы VI гр. S, Se и Те реагируют с К. с заметной скоростью при умеренном нагревании. Заметное окисление W и Мо наблюдается выше 400 °С, Cr - при значительно более высокой т-ре.
К. энергично окисляет орг. соединения. Горение жидких топлив и горючего газа происходит в результате р-ции К. с углеводородами. (энергия возбуждения 156,8 кДж/моль).
К.-наиб. распространенный элемент на Земле. В атмосфере содержится 23,10% по массе (20,95% по объему) своб. К., в гидросфере и литосфере - соотв. 85,82 и 47% по массе связанного К. Известно более 1400 минералов, в состав к-рых входит К. Убыль К. в атмосфере в результате окисления, в т. ч. горения, гниения и дыхания, возмещается выделением К. растениями при фотосинтезе. К. входит в состав всех в-в, из к-рых построены живые организмы; в организме человека его содержится ок. 65%.
Свойства. К.-бесцв. газ без запаха и вкуса. Т. кип. 90,188 К, т-ра тройной точки 54,361 К; плотн. при 273 К и нормальном давлении 1,42897 г/л, плотн. (в кг/м3) при 300 К: 6,43 (0,5 МПа), 12,91 (1 МПа), 52,51 (4 МПа); tкрит 154,581 К, ркрит 5.043 МПа, dкрит 436,2 кг/м3; С0p 29,4 Дж/(моль.К); DH0исп 6,8 кДж/моль (90,1 К); SO299 205,0 ДжДмоль.К); ур-ние температурной зависимости давления пара: в интервале 54-150 К lgp(гПа)=7,1648-377,153/T; теплопроводность 0,02465 Вт/(м.К) при 273 К; h 205,23 10-7 Па.с (298 К).
Жидкий К. окрашен в голубой цвет; плотн. 1,14 г/см3 (90,188 К); COp 54,40 Дж/(моль.К); теплопроводность 0,147 ВтДм.К) (90 К, 0,1 МПа); h 1,890.10-2 Па.с; g 13,2.10-5 Н/м (90 К), ур-ние температурной зависимости g=-38,46.10-3(1 - T/154,576)11/9 Н/м; nD 1,2149 (l=546,1 нм; 100 К); неэлектропроводен; молярная магн. восприимчивость 7,699.10-3 (90,1 К).
Твердый К. существует в неск. кристаллич. модификациях. Ниже 23,89 К устойчива а-форма с объемноцентрир. ром-бич, решеткой (при 21 К и 0,1 МПа а = 0,55 нм, b= 0,382 нм, с=0,344 нм, плотн. 1,46 г/см3), при 23,89-43,8 К-b-форма с гексаген, кристаллич. решеткой (при 28 К и 0,1 МПа а = 0,3307 нм, с = 1,1254 нм), выше 43,8 К существует g-форма с кубич. решеткой (а = 0,683 нм); DH° полиморфных переходов g:b 744 Дж/моль (43,818 К), b:a 93,8 Дж/моль (23,878 К); тройная точка b-g-газообразный К.: т-ра 283 К, давление 5,0 ГПа; DHOпл 443 Дж/молъ; ур-ние температурной зависимости плотности d=1,5154-0,004220T г/см3 (44 54 К), a-, b- и g- О2 кристаллы светло-синего цвета. Модификация р антиферромагнитна, a и g парамагнитны, их магн. восприимчивость соотв. 1,760.10-3 (23,7 К) и 1,0200.10-5 (54,3 К). При 298 К и повышении давления до 5,9 ГПа К. кристаллизуется, образуя окрашенную в розовый цвет гексаген. b-форму (а = 0,2849 нм, с = 1,0232 нм), а при повышении давления до 9 ГПа оранжевую ромбич. e-форму (при 9,6 ГПа а=0,42151 нм, b=0,29567 нм, с=0,66897 нм, плотн. 2,548 г/см3).
Р-римость К. при атм. давлении и 293 К (в см3/см3): в воде 0,031, этаноле 0,2201, метаноле 0,2557, ацетоне 0,2313; р-римость в воде при 373 К 0,017 см3/см3; р-римость при 274 К (в % по объему): в перфторбутилтетрагидрофуране 48,5, перфтордекалине 45,0, перфтор-l-метилдекалине 42,3. Хорошие твердые поглотители К. платиновая чернь и активный древесный уголь. Благородные металлы в расплавл. состоянии поглощают значит. кол-ва К., напр. при 960 °С один объем серебра поглощает ~22 объема К., к-рый при
охлаждении почти полностью выделяется. Способностью поглощать К. обладают мн. твердые металлы и оксиды, при этом образуются нестехиометрич. соединения.
К. отличается высокой хим. активностью, образуя соед. со всеми элементами, кроме Не, Ne и Аr. Атом К. в хим. соед. обычно приобретает электроны и имеет отрицат. эффективный заряд. Соед., в к-рых электроны оттягиваются от атома К., крайне редки (напр., OF2). С простыми в-вами, кроме Au, Pt, Xe и Кr, К. реагирует непосредственно при обычных условиях или при нагр., а также в присут. катализаторов. Р-ции с галогенами проходят под действием электрич. разряда или УФ излучения. В р-циях со всеми простыми в-вами, кроме F2, К. является окислителем.
Мол. К. образует три разл. ионные формы, каждая из к-рых дает начало классу соед.: О-2 - супероксидам, О22- - пeроксидам (см. Пероксидные соединения неорганические
, Пе-роксидные соединения органические), О+2 - диоксигенильным соeдинениям
. Озон образует озониды, в к-рых ионная форма К.-О-3. Молекула О2 присоединяется как слабый лиганд к нек-рым комплексам Fe, Co, Мn, Сu. Среди таких соед. важное значение имеет гемоглобин, к-рый осуществляет перенос К. в организме теплокровных.
Р-ции с К., сопровождающиеся интенсивным выделением энeргии, наз. горением
. Большую роль играют взаимод. К. с металлами в присут. влаги-атм. коррозия металлов
, а также дыхание
живых организмов и гниение. В результате гниения сложные орг. в-ва погибших животных и растений превращаются в более простые и в конечном счете в СО2 и волу.
С водородом К. реагирует с образованием воды и выделением большого кол-ва тепла (286 кДж на моль Н2). При комнатной т-ре р-ция идет крайне медленно, в присут. катализаторов - сравнительно быстро уже при 80-100 °С (эту р-цию используют для очистки Н2 и инертных газов от примеси О2). Выше 550 °С р-ция Н2 с О2 сопровождается взрывом.
Из элементов I гр. наиб. легко реагируют с К. Rb и Cs, к-рые самовоспламеняются на воздухе, К, Na и Li реагируют с К. медленнее, р-ция ускоряется в присут. паров воды. При сжигании щелочных металлов (кроме Li) в атмосфере К. образуются пероксиды М2О2 и супероксиды МО2. С элементами подгруппы IIа К. реагирует сравнительно легко, напр., Ва способен воспламеняться на воздухе при 20-25°С, Mg и Be воспламеняются выше 500 °С; продукты р-ции в этих случаях - оксиды и пероксиды. С элементами подгруппы IIб К. взаимод. с большим трудом, р-ция К. с Zn, Cd и Hg происходит только при более высоких т-рах (известны породы, в к-рых Hg содержится в элементарной форме). На пов-стях Zn и Cd образуются прочные пленки их оксидов, предохраняющие металлы от дальнейшего окисления.
Элементы III гр. реагируют с К. только при нагр., образуя оксиды. Компактные металлы Ti, Zr, Hf устойчивы к действию К. С углеродом К. реагирует с образованием СО2 и выделением тепла (394 кДж/моль); с аморфным углеродом р-ция протекает при небольшом нагревании, с алмазом и графитом - выше 700 °С.
С азотом К. реагирует лишь выше 1200°С с образованием NO, к-рый далее легко окисляется К. до NO2 уже при комнатной т-ре. Белый фосфор склонен к самовозгоранию на воздухе при комнатной т-ре.
Элементы VI гр. S, Se и Те реагируют с К. с заметной скоростью при умеренном нагревании. Заметное окисление W и Мо наблюдается выше 400 °С, Cr - при значительно более высокой т-ре.
К. энергично окисляет орг. соединения. Горение жидких топлив и горючего газа происходит в результате р-ции К. с углеводородами.
Получение. В пром-сти К. получают воздуха разделением
, гл. обр. методом низкотемпературной ректификации. Его производят также наряду с Н2 при пром. электролизе воды. Выпускают газообразный технол. К. (92-98% О2), техн. (1-й сорт 99,7% О2, 2-й сорт 99,5% и 3-й сорт 99,2%) и
жидкий (не менее 99,7% О2). Производится также К. для лечебных целей ("медицинский кислород", содержащий 99,5% O2).
Для дыхания в замкнутых помещениях (подводные лодки, космич. аппараты и др.) используют твердые источники К., действие к-рых основано на самораспространяющейся экзо-термич. р-ции между носителем К. (хлоратом или перхлоратом) и горючим. Напр., смесь NaClO3 (80%), порошка Fe (10%), ВаО2 (4%) и стекловолокна (6%) прессуют в виде цилиндров; после поджигания такая кислородная свеча горит со скоростью 0,15-0,2 мм/с, выделяя чистый, пригодный для дыхания К. в кол-ве 240 л/кг (см. Пиротехнические источники газов
).
В лаборатории К. получают разложением при нагр. оксидов (напр., HgO) или кислородсодержащих солей (напр., КСlO3, КМnО4), а также электролизом водного р-ра NaOH. Однако чаще всего используют пром. К., поставляемый в баллонах под давлением.
Определение. Концентрацию К. в газах определяют с помощью ручных газоанализаторов, напр. волюмометрич. методом по изменению известного объема анализируемой пробы после поглощения из нее О2 р-рами - медноаммиачным, пирогаллола, NaHSO3 и др. Для непрерывного определения К. в газах применяются автоматич. термомагн. газоанализаторы, основанные на высокой магн. восприимчивости К. Для определения малых концентраций К. в инертных газах или водороде (менее 1%) используют автоматич. термохим., электрохим., гальванич. и др. газоанализаторы. С этой же целью применяют колориметрич. метод (с использованием прибора Мугдана), основанный на окислении бесцв. аммиачного комплекса Cu(I) в яркоокра-шенное соед. Cu(II). К., растворенный в воде, определяют также колориметрически, напр. по образованию красного окрашивания при окислении восстановленного индигокар-мина. В орг. соед. К. определяют в виде СО или СО2 после высокотемпературного пиролиза анализируемого в-ва в потоке инертного газа. Для определения концентрации К. в стали и сплавах используют электрохим. датчики с твердым электролитом (стабилизированный ZrO2). См. также Газовый анализ
, Газоанализаторы
.
Применение. К. используют как окислитель: в металлургии - при выплавке чугуна и стали (в доменном, кислородно-конвертерном и мартеновском произ-вах), в процессах шахтной, взвешенной и конвертерной плавки цветных металлов; в прокатном произ-ве; при огневой зачистке металлов; в литейном произ-ве; при термитной сварке и резке металлов; в хим. и нефтехим. пром-сти-при произ-ве HNO3, H2SO4, метанола, ацетилена; формальдегида, оксидов, пероксидов и др. в-в. К. используют в лечебных целях в медицине, а также в кислородно-дыхат. аппаратах (в космич. кораблях, на подводных судах, при высотных полетах, подводных и спасательных работах). Жидкий К.-окислитель для ракетных топлив; его используют также при взрывных работах, как хладагент в лаб. практике.
Произ-во К. в США 10,75 млрд. м3 (1985); в металлургии потребляется 55% производимого К., в хим. промсти - 20%.
К. нетоксичен и негорюч, но поддерживает горение. В смеси с жидким К. взрывоопасны все углеводороды, в т.ч. масла, CS2. наиб. опасны малорастворимые горючие примеси, переходящие в жидком К. в твердое состояние (напр., ацетилен, пропилен, CS2). Предельно допустимое содержание в жидком К.: ацетилена 0,04 см3/л, CS2 0,04 см3/л, масла 0,4 мг/л.
Газообразный К. хранят и транспортируют в стальных баллонах малой (0,4-12 л) и средней (20-50 л) емкости при давлении 15 и 20 МПа, а также в баллонах большой емкости (80-1000 л при 32 и 40 МПа), жидкий К. в сосудах Дьюара или в спец. цистернах. Для транспортировки жидкого и газообразного К. используют также спец. трубопроводы. Кислородные баллоны окрашены в голубой цвет и имеют надпись черными буквами "кислород".
Впервые К. в чистом виде получил К. Шееле в 1771. Независимо от него К. был получен Дж. Пристли в 1774. В 1775 А. Лавуазье установил, что К.-составная часть воздуха, к-т и содержится во мн. в-вах.
Лит.. Глизмаяенко Д.Л., Получение кислорода, 5 изд., М., 1972; Разумовский С. Д., Кислород-элементарные формы и свойства, М., 1979; Термодинамические свойства кислорода, М., 1981. Я. Д. Зельвенский.
|

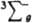 ) два валентных электрона молекулы О2, находящиеся на разрыхляющих орбиталях pх и pу, не спарены, благодаря чему К. парамагнитен (единств, парамагнитный газ, состоящий из гомоядерных двухатомных молекул); молярная магн. восприимчивость для газа 3,4400.10 (293 К), изменяется обратно пропорционально абс. т-ре (закон Кюри). Существуют два долгоживущих возбужденных состояния О2 - синглетное 1Dg (энергия возбуждения 94,1 кДж/моль, время жизни 45 мин) и синглетное
) два валентных электрона молекулы О2, находящиеся на разрыхляющих орбиталях pх и pу, не спарены, благодаря чему К. парамагнитен (единств, парамагнитный газ, состоящий из гомоядерных двухатомных молекул); молярная магн. восприимчивость для газа 3,4400.10 (293 К), изменяется обратно пропорционально абс. т-ре (закон Кюри). Существуют два долгоживущих возбужденных состояния О2 - синглетное 1Dg (энергия возбуждения 94,1 кДж/моль, время жизни 45 мин) и синглетное 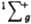 (энергия возбуждения 156,8 кДж/моль).
К.-наиб. распространенный элемент на Земле. В атмосфере содержится 23,10% по массе (20,95% по объему) своб. К., в гидросфере и литосфере - соотв. 85,82 и 47% по массе связанного К. Известно более 1400 минералов, в состав к-рых входит К. Убыль К. в атмосфере в результате окисления, в т. ч. горения, гниения и дыхания, возмещается выделением К. растениями при фотосинтезе. К. входит в состав всех в-в, из к-рых построены живые организмы; в организме человека его содержится ок. 65%.
Свойства. К.-бесцв. газ без запаха и вкуса. Т. кип. 90,188 К, т-ра тройной точки 54,361 К; плотн. при 273 К и нормальном давлении 1,42897 г/л, плотн. (в кг/м3) при 300 К: 6,43 (0,5 МПа), 12,91 (1 МПа), 52,51 (4 МПа); tкрит 154,581 К, ркрит 5.043 МПа, dкрит 436,2 кг/м3; С0p 29,4 Дж/(моль.К); DH0исп 6,8 кДж/моль (90,1 К); SO299 205,0 ДжДмоль.К); ур-ние температурной зависимости давления пара: в интервале 54-150 К lgp(гПа)=7,1648-377,153/T; теплопроводность 0,02465 Вт/(м.К) при 273 К; h 205,23 10-7 Па.с (298 К).
Жидкий К. окрашен в голубой цвет; плотн. 1,14 г/см3 (90,188 К); COp 54,40 Дж/(моль.К); теплопроводность 0,147 ВтДм.К) (90 К, 0,1 МПа); h 1,890.10-2 Па.с; g 13,2.10-5 Н/м (90 К), ур-ние температурной зависимости g=-38,46.10-3(1 - T/154,576)11/9 Н/м; nD 1,2149 (l=546,1 нм; 100 К); неэлектропроводен; молярная магн. восприимчивость 7,699.10-3 (90,1 К).
Твердый К. существует в неск. кристаллич. модификациях. Ниже 23,89 К устойчива а-форма с объемноцентрир. ром-бич, решеткой (при 21 К и 0,1 МПа а = 0,55 нм, b= 0,382 нм, с=0,344 нм, плотн. 1,46 г/см3), при 23,89-43,8 К-b-форма с гексаген, кристаллич. решеткой (при 28 К и 0,1 МПа а = 0,3307 нм, с = 1,1254 нм), выше 43,8 К существует g-форма с кубич. решеткой (а = 0,683 нм); DH° полиморфных переходов g:b 744 Дж/моль (43,818 К), b:a 93,8 Дж/моль (23,878 К); тройная точка b-g-газообразный К.: т-ра 283 К, давление 5,0 ГПа; DHOпл 443 Дж/молъ; ур-ние температурной зависимости плотности d=1,5154-0,004220T г/см3 (44 54 К), a-, b- и g- О2 кристаллы светло-синего цвета. Модификация р антиферромагнитна, a и g парамагнитны, их магн. восприимчивость соотв. 1,760.10-3 (23,7 К) и 1,0200.10-5 (54,3 К). При 298 К и повышении давления до 5,9 ГПа К. кристаллизуется, образуя окрашенную в розовый цвет гексаген. b-форму (а = 0,2849 нм, с = 1,0232 нм), а при повышении давления до 9 ГПа оранжевую ромбич. e-форму (при 9,6 ГПа а=0,42151 нм, b=0,29567 нм, с=0,66897 нм, плотн. 2,548 г/см3).
Р-римость К. при атм. давлении и 293 К (в см3/см3): в воде 0,031, этаноле 0,2201, метаноле 0,2557, ацетоне 0,2313; р-римость в воде при 373 К 0,017 см3/см3; р-римость при 274 К (в % по объему): в перфторбутилтетрагидрофуране 48,5, перфтордекалине 45,0, перфтор-l-метилдекалине 42,3. Хорошие твердые поглотители К. платиновая чернь и активный древесный уголь. Благородные металлы в расплавл. состоянии поглощают значит. кол-ва К., напр. при 960 °С один объем серебра поглощает ~22 объема К., к-рый при
охлаждении почти полностью выделяется. Способностью поглощать К. обладают мн. твердые металлы и оксиды, при этом образуются нестехиометрич. соединения.
К. отличается высокой хим. активностью, образуя соед. со всеми элементами, кроме Не, Ne и Аr. Атом К. в хим. соед. обычно приобретает электроны и имеет отрицат. эффективный заряд. Соед., в к-рых электроны оттягиваются от атома К., крайне редки (напр., OF2). С простыми в-вами, кроме Au, Pt, Xe и Кr, К. реагирует непосредственно при обычных условиях или при нагр., а также в присут. катализаторов. Р-ции с галогенами проходят под действием электрич. разряда или УФ излучения. В р-циях со всеми простыми в-вами, кроме F2, К. является окислителем.
Мол. К. образует три разл. ионные формы, каждая из к-рых дает начало классу соед.: О-2 - супероксидам, О22- - пeроксидам (см.
(энергия возбуждения 156,8 кДж/моль).
К.-наиб. распространенный элемент на Земле. В атмосфере содержится 23,10% по массе (20,95% по объему) своб. К., в гидросфере и литосфере - соотв. 85,82 и 47% по массе связанного К. Известно более 1400 минералов, в состав к-рых входит К. Убыль К. в атмосфере в результате окисления, в т. ч. горения, гниения и дыхания, возмещается выделением К. растениями при фотосинтезе. К. входит в состав всех в-в, из к-рых построены живые организмы; в организме человека его содержится ок. 65%.
Свойства. К.-бесцв. газ без запаха и вкуса. Т. кип. 90,188 К, т-ра тройной точки 54,361 К; плотн. при 273 К и нормальном давлении 1,42897 г/л, плотн. (в кг/м3) при 300 К: 6,43 (0,5 МПа), 12,91 (1 МПа), 52,51 (4 МПа); tкрит 154,581 К, ркрит 5.043 МПа, dкрит 436,2 кг/м3; С0p 29,4 Дж/(моль.К); DH0исп 6,8 кДж/моль (90,1 К); SO299 205,0 ДжДмоль.К); ур-ние температурной зависимости давления пара: в интервале 54-150 К lgp(гПа)=7,1648-377,153/T; теплопроводность 0,02465 Вт/(м.К) при 273 К; h 205,23 10-7 Па.с (298 К).
Жидкий К. окрашен в голубой цвет; плотн. 1,14 г/см3 (90,188 К); COp 54,40 Дж/(моль.К); теплопроводность 0,147 ВтДм.К) (90 К, 0,1 МПа); h 1,890.10-2 Па.с; g 13,2.10-5 Н/м (90 К), ур-ние температурной зависимости g=-38,46.10-3(1 - T/154,576)11/9 Н/м; nD 1,2149 (l=546,1 нм; 100 К); неэлектропроводен; молярная магн. восприимчивость 7,699.10-3 (90,1 К).
Твердый К. существует в неск. кристаллич. модификациях. Ниже 23,89 К устойчива а-форма с объемноцентрир. ром-бич, решеткой (при 21 К и 0,1 МПа а = 0,55 нм, b= 0,382 нм, с=0,344 нм, плотн. 1,46 г/см3), при 23,89-43,8 К-b-форма с гексаген, кристаллич. решеткой (при 28 К и 0,1 МПа а = 0,3307 нм, с = 1,1254 нм), выше 43,8 К существует g-форма с кубич. решеткой (а = 0,683 нм); DH° полиморфных переходов g:b 744 Дж/моль (43,818 К), b:a 93,8 Дж/моль (23,878 К); тройная точка b-g-газообразный К.: т-ра 283 К, давление 5,0 ГПа; DHOпл 443 Дж/молъ; ур-ние температурной зависимости плотности d=1,5154-0,004220T г/см3 (44 54 К), a-, b- и g- О2 кристаллы светло-синего цвета. Модификация р антиферромагнитна, a и g парамагнитны, их магн. восприимчивость соотв. 1,760.10-3 (23,7 К) и 1,0200.10-5 (54,3 К). При 298 К и повышении давления до 5,9 ГПа К. кристаллизуется, образуя окрашенную в розовый цвет гексаген. b-форму (а = 0,2849 нм, с = 1,0232 нм), а при повышении давления до 9 ГПа оранжевую ромбич. e-форму (при 9,6 ГПа а=0,42151 нм, b=0,29567 нм, с=0,66897 нм, плотн. 2,548 г/см3).
Р-римость К. при атм. давлении и 293 К (в см3/см3): в воде 0,031, этаноле 0,2201, метаноле 0,2557, ацетоне 0,2313; р-римость в воде при 373 К 0,017 см3/см3; р-римость при 274 К (в % по объему): в перфторбутилтетрагидрофуране 48,5, перфтордекалине 45,0, перфтор-l-метилдекалине 42,3. Хорошие твердые поглотители К. платиновая чернь и активный древесный уголь. Благородные металлы в расплавл. состоянии поглощают значит. кол-ва К., напр. при 960 °С один объем серебра поглощает ~22 объема К., к-рый при
охлаждении почти полностью выделяется. Способностью поглощать К. обладают мн. твердые металлы и оксиды, при этом образуются нестехиометрич. соединения.
К. отличается высокой хим. активностью, образуя соед. со всеми элементами, кроме Не, Ne и Аr. Атом К. в хим. соед. обычно приобретает электроны и имеет отрицат. эффективный заряд. Соед., в к-рых электроны оттягиваются от атома К., крайне редки (напр., OF2). С простыми в-вами, кроме Au, Pt, Xe и Кr, К. реагирует непосредственно при обычных условиях или при нагр., а также в присут. катализаторов. Р-ции с галогенами проходят под действием электрич. разряда или УФ излучения. В р-циях со всеми простыми в-вами, кроме F2, К. является окислителем.
Мол. К. образует три разл. ионные формы, каждая из к-рых дает начало классу соед.: О-2 - супероксидам, О22- - пeроксидам (см.