Химическая энциклопедия
"МОЛЕКУЛЯРНАЯ МАССА"
Главная - Химическая энциклопедия - буква М - МОЛЕКУЛЯРНАЯ МАССА
МОЛЕКУЛЯРНАЯ МАССА
,
сумма масс атомов, входящих в состав данной молекулы; выражается в атомных
единицах массы (а.е. м.). Поскольку 1 а.е.м. (иногда называемая дальтон, D)
равна 1/12 массы атома нуклида 12С и в единицах
массы СИ составляет 1,66057.10-27 кг, то умножение М.м.
на 1,66057.10-27 дает абс. массу молекулы в килограммах.
Чаще пользуются безразмерной величиной Мотн-относительной
М.м.: Мотн =Mx/D, где Мх-масса
молекулы x, выраженная в тех же единицах массы (кг, г или др.), что и
D. М. м. характеризует среднюю массу молекулы с учетом изотопного состава всех
элементов, образующих данное хим. соединение. Иногда М. м. определяют для смеси
разл. в-в известного состава, напр. для воздуха "эффективную" М.м.
можно принять равной 29. Абс. массами молекул удобно
оперировать в области физики субатомных процессов и радиохимии, где путем измерения
энергии частиц, согласно теории относительности, определяют их абс. массы. В
химии и хим. технологии необходимо применять макроскопич. единицы измерения
кол-ва в-ва. Число любых частиц (молекул, атомов, электронов
или мысленно выделяемых в в-ве групп частиц, напр. пар ионов Na+
и Сl- в кристаллич. решетке NaCl), равное Авогадро постоянной NА = 6,022.1023, составляет макроскопич.
единицу кол-ва в-ва-моль. Тогда можно записать: Мотн = Mx.NA/(D.NA),T.е.
относительная М.м. равна отношению массы моля в-ва к NAD.
Если в-во состоит из молекул с ковалентными связями между составляющими их атомами,
то величина Mx.NA представляет
собой м о л я рн у ю м а с с у этого в-ва, единицы измерения к-рой кг-моль (киломоль,
кМ). Для в-в, не содержащих молекул, а состоящих из атомов, ионов или радикалов,
определяется ф о р-м у л ь н а я м о л я р н а я м а с с а, т.е. масса NA
частиц, соответствующих принятой формуле в-ва (однако в СССР часто и в этом
случае говорят о М.м., что неверно). Ранее в химии использовали
понятия грамм-молекула, грамм-атом, грамм-ион, теперь-моль молекул, моль атомов,
моль ионов, подразумевая под этим NA молекул, атомов, ионов
и соотв. их молярные массы, выраженные в граммах или килограммах. Традиционно
употребляют в качестве синонима термин "молекулярный (молярный) вес",
т. к. определение массы производится с помощью весов. Но, в отличие от веса,
зависящего от географич. координат, масса является постоянным параметром кол-ва
в-ва (при обычных скоростях движения частиц в условиях хим. р-ций), поэтому
правильнее говорить "молекулярная масса". Большое число устаревших
терминов и понятий, касающихся М. м., объясняется тем, что до эры космич. полетов
в химии не придавали значения различию между массой и весом, к-рое обусловлено
разностью значений ускорения своб. падения на полюсах (9,83 м.с-2)
и на экваторе (9,78 м.с-2); при расчетах силы тяжести
(веса) обычно пользуются средним значением, равным 9,81 м.с-2.
Кроме того, развитие понятия молекулы (как и атома) было связано с исследованием
макроскопич. кол-в в-ва в процессах их хим. (реакции) или физ. (фазовые переходы)
превращений, когда не была разработана теория строения в-ва (19 в.) и предполагалось,
что все хим. соед. построены только из атомов и молекул. Методы определения.
Исторически первый метод (обоснованный исследованиями С. Канниццаро и А.
Авогадро) предложен Ж. Дюма в 1827 и заключался в измерении плотности газообразных
в-в относительно водородного газа, молярная масса к-рого принималась первоначально
равной 2, а после перехода к кислородной единице измерений молекулярных и атомных
масс-2,016 г. След. этап развития эксперим. возможностей определения М.м. заключался
в исследовании жидкостей и р-ров нелетучих и недиссоциирующих в-в путем измерения
коллигативных св-в (т. е. зависящих только от числа растворенных частиц) - осмотич.
давления (см. Осмометрия
), понижения давления пара, понижения точки замерзания
(криоскопия
)и повышения точки кипения (эбулиоскопия
)р-ров по
сравнению с чистым р-рителем. При этом было открыто "аномальное"
поведение электролитов. Понижение давления пара
над р-ром зависит от молярной доли растворенного в-ва (закон Рауля): [(р - р0)/р] = N, где р0-давление
пара чистого р-рителя, р-
давление пара над р-ром, N-
молярная
доля исследуемого растворенного в-ва, N = (тх/Мх)/[(тх/Мх)
+ (m0/M0)], mx и Мх-соотв.
навеска (г) и М.м. исследуемого в-ва, m0 и М0-то
же для р-рителя. В ходе определений проводят экстраполяцию к бесконечно разб.
р-ру, т.е. устанавливают Для определения М.м. используют
также изотермич. перегонку р-рителя. При этом пробу р-ра исследуемого в-ва вносят
в камеру с насыщ. паром р-рителя (при данной т-ре); пары р-рителя конденсируются,
т-ра р-ра повышается и после установления равновесия вновь понижается; по изменению
т-ры судят о кол-ве выделившейся теплоты испарения, к-рая связана с М.м. растворенного
в-ва. В т. наз. изопиестич. методах проводят изотермич. перегонку р-рителя в
замкнутом объеме, напр. в Н-образном сосуде. В одном колене сосуда находится
т. наз. р-р сравнения, содержащий известную массу в-ва известной М. м. (молярная
концентрация C1), в другом-р-р, содержащий известную массу исследуемого
в-ва (молярная концентрация С2 неизвестна). Если, напр., С1
> С2, р-ритель перегоняется из второго колена в первое, пока
молярные концентрации в обоих коленах не будут равны. Сопоставляя объемы полученных
изопиестич. р-ров, рассчитывают М.м. неизвестного в-ва. Для определения М.м.
можно измерять массу изопиестич. р-ров с помощью весов Мак-Бена, к-рые представляют
собой две чашечки, подвешенные на пружинках в закрытом стеклянном сосуде; в
одну чашечку помещают исследуемый р-р, в другую-р-р сравнения; по изменению
положения чашечек определяют массы изопиестич. р-ров и, следовательно, М.м.
исследуемого в-ва. Осн. методом определения
атомных и мол. масс летучих в-в является масс-спектрометрия
. Для исследования
смеси соед. эффективно использование хромато-масс-спектромет-рии. При
малой интенсивности пика мол. иона применяют эффузиометрич. приставки к масс-спектрометрам.
Эффузио-метрич. способ основан на том, что скорость вытекания газа в вакуум
из камеры через отверстие, диаметр к-рого значительно меньше среднего пути своб.
пробега молекулы, обратно пропорциональна квадратному корню из М.м. в-ва; скорость
вытекания контролируют по изменению давления в камере. М.м. летучих соед. определяют
также методами газовой хроматографии с газовыми весами Мартина. Последние измеряют
скорость перемещения газа в канале, соединяющем трубки, по к-рым текут газ-носитель
и газ из хроматографич. колонки, что позволяет определять разницу плотностей
этих газов, зависящую от М.м. исследуемого в-ва. М. м. измеряют для идентификации
хим. соед., для установления содержания отдельных нуклидов в соед., напр. в
воде, используемой в атомных энергетич. установках, а также при исследовании
и синтезе высокомол. соед., св-ва к-рых существенно зависят от их М.м. (см. Молекулярная масса полимера
). Средние значения М.м. полимеров устанавливают
с помощью перечисленных выше методов, основанных на коллигативных св-вах разбавленных
р-ров, по числу двойных связей ("мягким" озонолизом) или функц.
групп (методами функцион. анализа), а также по таким св-вам их р-ров, как вязкость,
светорассеяние. Средние значения мол. масс полимеров высокой степени полимеризации
определяют по их реологич. характеристикам. Лит.: Рафиков С.
Р., Павлова С. А., Твердохлебова И. И., Методы определения молекулярных весов
и полидисперсности высокомолекулярныхсоединений, М., 1963; Полинг Л., Полинг
П., Химия, пер. с англ., М., 1978; Вилков Л. В., Пентин Ю. А., Физические
методы исследования в химии, М., 1987. Ю.А.Клячко. |
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: МОЛЕКУЛЯРНАЯ МАССА
будет выглядеть так: Что такое МОЛЕКУЛЯРНАЯ МАССА
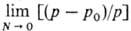 для р-ров исследуемого в-ва и для р-ров известного (стандартного) хим.
соединения. В случае криоскопии и эбулиоскопии используют зависимости соотв.
Dt3 = Кс и Dtк = Еc, где Dt3-понижение
т-ры замерзания р-ра, Dtк - повышение т-ры кипения р-ра, К и
для р-ров исследуемого в-ва и для р-ров известного (стандартного) хим.
соединения. В случае криоскопии и эбулиоскопии используют зависимости соотв.
Dt3 = Кс и Dtк = Еc, где Dt3-понижение
т-ры замерзания р-ра, Dtк - повышение т-ры кипения р-ра, К и