Химическая энциклопедия
"ЭЛЕКТРОДЫ"
Главная - Химическая энциклопедия - буква Э - ЭЛЕКТРОДЫ
ЭЛЕКТРОДЫ в электрохимии, электронно-проводящие фазы, контактирующие с ионным проводником (электролитом). Часто под Э. понимают лишь одну электронно-проводящую фазу. При пропускании тока от внеш. источника через систему из двух электродов, соединенных друг с другом через электролит, на Э. протекают два процесса: заряжение двойного электрического слоя и электрохим. р-ция. В отличие от фазовых контактов металл-металл, металл-полупроводник, полупроводник-полупроводник и т. п. на фанице фаз, составляющих электрохим. систему, вид носителей тока меняется, т. к. в электролите ток переносится ионами, а в электронно-проводящей фазе - электронами. Непрерывность прохождения тока через фаницу фаз в этом случае обеспечивается электродной р-цией. Э. наз. анодом, если на его пов-сти преобладает р-ция, приводящая к генерированию электронов, т. е. происходит окисление в-в, содержащихся в электролите, либо ионизация металла анода. Э. наз. катодом, если с его пов-сти электроны металла переходят на частицы реагирующих в-в, к-рые при этом восстанавливаются. Классификация Э. проводится по природе
окислителей и восстановителей, к-рые участвуют в электродном процессе.
Э. 1-го рода наз. металл (или неметалл), пофуженный в электролит, содержащий
ионы этого же элемента. Металл Э. является восстановленной формой в-ва,
а его окисленной формой - простые или комплексные ионы этого же металла
(см. Электрохимическая кинетика
). Напр., для системы Сu
где E° - стандартный потенциал при
т-ре Т;
где aтl, - термодинамич. активность
таллия в амальгаме.
где
К Э. 2-го рода относятся многие электроды сравнения
, напр. каломельный, хлорсеребряный, оксидно-ртутный.
Металл Э. может не участвовать в р-циях,
а служить лишь передатчиком электронов от восстановленной формы в-ва к
окисленной; такие Э. наз. окислительно-восстановительными или редокс-электродами.
Напр., платиновый Э. в р-ре, содержащем ионы [Fe(CN)6]4-
и [Fe(CN)6]3-, осуществляет перенос электронов между
этими ионами в качестве передатчика (медиатора). Среди окислит.-восстановит.
Э. выделяют газовые Э., состоящие из химически инертного металла (обычно
Pt), к к-рому подводится электрохимически активный газ (напр., Н2
или С12). Молекулы газа адсорбируются на пов-сти металла, распадаясь
на адсорбиров. атомы, к-рые непосредственно участвуют в переносе электронов
через границу раздела фаз. Наиб. распространен водородный Э.,на пов-сти
к-рого образуются адсорбир. атомы Надс и устанавливается равновесие:
Н2 Модифицирование Э., получившее широкое распространение в электрокатализе , произ-ве химических источников тока, электрохимических сенсоров и т. п., основано как на физических (ионная имплантация, разрыхление пов-сти, выращивание монокристаллич. граней, создание монокристаллич. структур, физ. адсорбция ионов и молекул и др.), так и хим. методах. В частности, химически модифицированные Э. представляют собой проводящий или полупроводниковый материал, покрытый мономолекулярными (в т. ч. субатомными), полимолекулярными, ионными, полимерными слоями, в результате чего Э. проявляет хим., электрохим. и/или оптич. св-ва слоя. Хим. модифицирование достигается хемосорбцией на пов-сти Э. ионов и молекул, ковалентным связыванием разл. агентов с поверхностными атомными группами, покрытием пов-сти орг., металлорг. или неорг. полимерными слоями, созданием композитов из электродного материала и в-ва -модификатора. Микроэлектроды имеют по крайней
мере один из размеров настолько малый, что св-ва Э. оказываются размерно
зависимыми. Размеры микроэлектродов лсжат в интервале 0,1-50 мкм, миним.
площадь составляет 10-14 м2 (ультрамикроэлектроды),
тогда как в большинстве электроаналит. экспериментов применяют Э. с площадью
5 х 10-5м2, в лаб. электросинтезе - 10-2
м2. Осн. преимущество микроэлектродов - возможность снизить
с их помощью диффузионные ограничения скорости электродного процесса и,
следовательно, изучать кинетику очень быстрых электродных р-ций. Из-за
малой величины токов электрохим. ячейки с микроэлектродами характеризуются
незначительным омич. падением потенциала, что позволяет изучать системы
с высокими концентрациями реагирующих частиц, обычно используемые в технол.
процессах, применять высокие скорости сканирования потенциала при вольтамперометрич.
измерениях, проводить работы в плохо проводящих средах и т. п. Микроэлектроды
используют для анализа ультрамалых проб, исследования процессов в живых
организмах, в клинич. целях. Ультрамикроэлектроды применяют в туннельной
сканирующей микроскопии и в электрохим. нанотехнологии.
Лит.: Дамаскин Б.Б., Петрий О. А., Электрохимия, М., 1987; Багоцкий B.C., Основы электрохимии, М., 1988. О.А. Петрий.
|
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: ЭЛЕКТРОДЫ
будет выглядеть так: Что такое ЭЛЕКТРОДЫ
 Сu2+ + 2е, где е - электрон, восстановленной формой является
Сu, а окисленной - ионы Сu2+. Соответствующее такому электродному
процессу
Сu2+ + 2е, где е - электрон, восстановленной формой является
Сu, а окисленной - ионы Сu2+. Соответствующее такому электродному
процессу 
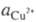 - термодинамич.
активность ионов Сu2+; F - постоянная Фарадея; R - газовая постоянная. КЭ. 1-го рода относятся амальгамные Э., т. к. для
них восстановленная форма - амальгама металла, а окисленная - ионы этого
же металла. Напр., для амальгамы таллия устанавливается равновесие: Tl+
+ e(Hg)
- термодинамич.
активность ионов Сu2+; F - постоянная Фарадея; R - газовая постоянная. КЭ. 1-го рода относятся амальгамные Э., т. к. для
них восстановленная форма - амальгама металла, а окисленная - ионы этого
же металла. Напр., для амальгамы таллия устанавливается равновесие: Tl+
+ e(Hg) Tl(Hg).
В такой системе могут изменяться концентрации и окисленной, и восстановленной
форм, поэтому ур-ние Нернста имеет вид:
Tl(Hg).
В такой системе могут изменяться концентрации и окисленной, и восстановленной
форм, поэтому ур-ние Нернста имеет вид:

 (или оксида) и погруженного в р-р, содержащий анионы этой соли (для оксида
-ионы ОН-). Окисленной формой является соль
(или оксида) и погруженного в р-р, содержащий анионы этой соли (для оксида
-ионы ОН-). Окисленной формой является соль а восстановленная форма представлена металлом М и анионом Az-:
а восстановленная форма представлена металлом М и анионом Az-:

 z - зарядовое число иона. В системе устанавливается равновесие между
атомами М и анионами Az-в р-ре, к-рое включает два "парциальных"
равновесия: между металлом и катионом соли и между анионом соли в ее твердой
фазе и анионом в р-ре. Такие Э. наз. обратимыми по аниону.
z - зарядовое число иона. В системе устанавливается равновесие между
атомами М и анионами Az-в р-ре, к-рое включает два "парциальных"
равновесия: между металлом и катионом соли и между анионом соли в ее твердой
фазе и анионом в р-ре. Такие Э. наз. обратимыми по аниону.


 2Надс
2Надс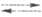 2Н+ + 2е. Разл. типы Э. можно объединить в рамках т. наз. концепции
электронного равновесия на границе металл-электролит, согласно к-рой каждому
равновесному электродному потенциалу соответствует определенная термодинамич.
активность электронов в электролите.
2Н+ + 2е. Разл. типы Э. можно объединить в рамках т. наз. концепции
электронного равновесия на границе металл-электролит, согласно к-рой каждому
равновесному электродному потенциалу соответствует определенная термодинамич.
активность электронов в электролите.