ЭЛЕКТРОКАТАЛИЗ
, изменение скорости
или направления электрохим. процесса в зависимости от материала электрода
или модификации его пов-сти. Термин "Э." относят к процессам, общие стехиометрич.
ур-ния к-рых не включают материал электрода, напр. выделение водорода,
кислорода, хлора, электроокисление или электровосстановление орг. соединений
и т. п. Электрохим. р-ции типа анодного растворения меди (Сu Сu2+ + 2е) или катодного восстановления анионов
Сu2+ + 2е) или катодного восстановления анионов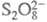 до
до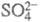 к электрокаталитическим
не относятся. к электрокаталитическим
не относятся.
Как правило, электрокаталитическими являются
многостадийные процессы, в к-рых одной из обязат. стадий является адсорбция
на электроде тех или иных компонентов электродной р-ции (исходных, промежуточных
или конечных). Это связано с тем, что с учетом структуры
двойного электрического слоя
скорость р-ции, не сопровождающейся адсорбцией, оказывается практически
не зависящей от материала электрода. Нек-рые ученые относят к Э. лишь процессы,
в к-рых имеет место хемосорбция к.-л. компонентов р-ции.
Типичным злектрокаталитич. процессом является
электроокисление орг. соед. на металлах платиновой группы, к-рое, как правило,
сопровождается деструкцией исходных молекул, их дегидрированием (или их
фрагментов), прочной хемосорбцией промежут. частиц, причем нек-рые из этих
частиц м. б. каталитич. ядами по отношению к токоопределяющему маршруту
анодного процесса. Так, электрокаталитич. окисление предельных углеводородов
(C1-C6) на Pt-электроде до СО2
обусловлено
наличием сложной цепочки промежут. стадий, включающей разрыв связей С —
С, С — Н, хемосорбцию фрагментов исходных молекул на пов-сти металла-катализатора,
участие в отд. стадиях адсорбир. молекул Н2Оадс или
частиц ОНадс и т. п. Граница между "чисто электрохимич." и электрокаталитич.
р-циями является весьма условной.
Осн. отличие электрокаталитич. р-ций от
гетерогенно-каталитических - зависимость скорости процесса от потенциала
электрода Е. Кинетич. ур-ние электрокаталитич. р-ции выражает аналит.
связь между током I через электрохим. ячейку и потенциалом Е,
объемной концентрацией сi исходных реагирующих в-в,
поверхностными концентрациями (заполнениями пов-сти) частиц, участвующих
в токоопределяющем маршруте (или маршрутах) процесса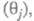 и других адсорбир. или хемосорбир. частиц, таких, как ионы р-ра, продукты
превращения исходных реагентов и молекул р-рителя и т. п.
и других адсорбир. или хемосорбир. частиц, таких, как ионы р-ра, продукты
превращения исходных реагентов и молекул р-рителя и т. п. В общем виде это выражение можно записать след. образом:
В общем виде это выражение можно записать след. образом:
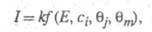
где k - постоянная. Меняя Е, можно
на неск. порядков изменить скорость целевой р-ции; при этом значение Е влияет как на энергию активации р-ции, так и (в осн.) на поверхностные
концентрации и
и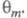 Во
мн. случаях с изменением Е меняются не только Во
мн. случаях с изменением Е меняются не только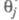 и
и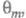 но
и природа частиц j и т, что приводит к изменению направления
электродного процесса. В Э., как и в жидкофазном катализе, важную роль
играет адсорбция р-рителя, однако спецификой Э. является возможность участия
в разл. стадиях процесса частиц, образующихся в результате электрохим.
р-ций с участием р-рителя (напр., в водных р-рах - частиц Надс
и ОНадс). Другая особенность Э.-адсорбция на пов-сти ионов фонового
электролита и ее влияние на электродные р-ции. но
и природа частиц j и т, что приводит к изменению направления
электродного процесса. В Э., как и в жидкофазном катализе, важную роль
играет адсорбция р-рителя, однако спецификой Э. является возможность участия
в разл. стадиях процесса частиц, образующихся в результате электрохим.
р-ций с участием р-рителя (напр., в водных р-рах - частиц Надс
и ОНадс). Другая особенность Э.-адсорбция на пов-сти ионов фонового
электролита и ее влияние на электродные р-ции.
Строгой теории, связывающей физ. и хим.
св-ва металла с его электрокаталитич. активностью, не существует даже для
относительно простых и ярко выраженных случаев Э. Это относится и к наиб.
изученной р-ции - ионизации-разряда водорода, ток обмена к-рой в зависимости
от природы электрода меняется более чем на 10 порядков (наименее активны
Hg, Cd, Pb, наиб. активны Pt, Rh, Ir). Представления о механизме Э. пока
носят феноменологич. характер. Влияние на скорость р-ции материала электрода
связывается прежде всего с изменением энергии адсорбции и степени заполнения
пов-сти частицами j и т. К наиб. активным электродным материалам
относятся металлы группы Pt и Ni, что, по-видимому, в первую очередь обусловлено
их высокой адсорбционной (хемосорбционной) способностью. В этом отношении
Э. аналогичен гетерогенному катализу.
Из неметаллич. электрокатализаторов неорг.
природы (оксидов, карбидов, сульфидов и др.) наиб. изучены оксидные системы
и углеродные материалы. Устойчивость оксидов при высоких анодных потенциалах
объясняет их преим. использование в р-циях электроокисления и электросинтеза
(типичный пример - применение оксидных рутениево-титановых анодов ОРТА
в процессе выделения хлора). Большое число функц. групп на пов-сти углеродных
материалов позволяет осуществлять на них широкий круг электрокаталит. процессов
с достаточно высокой селективностью.
Активность смешанных электрокатализаторов,
состоящих из неск. компонентов, часто оказывается выше активности отд.
составляющих. Напр., скорость электроокисления метанола на сплаве Pt-Ru
повышается на 3 порядка по сравнению со скоростью процесса на Pt. Выяснение
причин повышения активности при переходе к смешанным катализаторам включает
прежде всего установление корреляций между объемными и поверхностными св-вами
электрода, поскольку даже элементный состав поверхностного слоя нередко
может существенно отличаться от объемного состава.
В Э. широко используют модифицирование
пов-сти домонослойными, моно- или полислойными покрытиями. Адатомы, образующиеся
в результате адсорбции ионов с практически полным переносом заряда (напр.,
Sn2+ + 2e Snадс),
также нередко активируют пов-сть. Модифицирование пов-сти разл. непроводящими
орг. соед., включая металлоорг. комплексы и полимеры, позволяет создавать
системы со специфич. адсорбционными и каталитич. св-вами, обусловленными
в первую очередь функц. группами модификатора. Для таких систем часто используют
назв. "химически модифицированные электроды". Ускорение электрохим. р-ций
в присутствии биол. катализаторов - ферментов - часто наз. биоэлектрокатализом. Snадс),
также нередко активируют пов-сть. Модифицирование пов-сти разл. непроводящими
орг. соед., включая металлоорг. комплексы и полимеры, позволяет создавать
системы со специфич. адсорбционными и каталитич. св-вами, обусловленными
в первую очередь функц. группами модификатора. Для таких систем часто используют
назв. "химически модифицированные электроды". Ускорение электрохим. р-ций
в присутствии биол. катализаторов - ферментов - часто наз. биоэлектрокатализом.
Впервые термин "Э." был использован Н.
И. Кобозевым и В. В. Монблановой в 1934. Как самостоят. научное направление
Э. сформировался в 60-х гг. 20 в. в связи с проблемой создания топливных элементов
. Широкое развитие работ по Э. вызвано прежде всего запросами
практики. Активные и селективные электрокатализаторы необходимы для создания
высокоэкономичных процессов электролиза (в произ-вах водорода, кислорода,
хлора и т. д.) и электрохим. генераторов (водород-кислородных, на орг.
топливе и др.), для проведения и интенсификации электросинтеза орг. и неорг.
соед., разработки разнообразных датчиков (в т. ч. мед. назначения), решения
проблем экологии.
Лит.: Проблемы электрокатализа,
под ред. B.C. Багоцкого, М, 1980; Электродные процессы в растворах органических
соединений, под ред. Б. Б. Дамаскина, М., 1985; Appleby A. J., в кн.: Comprehensive
treatise of electrochemistry, v. 7, N. Y.- L., 1983, p. 173-239.
Б. И. Подловченко.
|

 Сu2+ + 2е) или катодного восстановления анионов
Сu2+ + 2е) или катодного восстановления анионов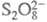 до
до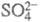 к электрокаталитическим
не относятся.
к электрокаталитическим
не относятся.
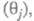 и других адсорбир. или хемосорбир. частиц, таких, как ионы р-ра, продукты
превращения исходных реагентов и молекул р-рителя и т. п.
и других адсорбир. или хемосорбир. частиц, таких, как ионы р-ра, продукты
превращения исходных реагентов и молекул р-рителя и т. п. В общем виде это выражение можно записать след. образом:
В общем виде это выражение можно записать след. образом:
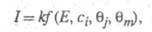
 и
и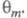 Во
мн. случаях с изменением Е меняются не только
Во
мн. случаях с изменением Е меняются не только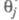 и
и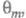 но
и природа частиц j и т, что приводит к изменению направления
электродного процесса. В Э., как и в жидкофазном катализе, важную роль
играет адсорбция р-рителя, однако спецификой Э. является возможность участия
в разл. стадиях процесса частиц, образующихся в результате электрохим.
р-ций с участием р-рителя (напр., в водных р-рах - частиц Надс
и ОНадс). Другая особенность Э.-адсорбция на пов-сти ионов фонового
электролита и ее влияние на электродные р-ции.
но
и природа частиц j и т, что приводит к изменению направления
электродного процесса. В Э., как и в жидкофазном катализе, важную роль
играет адсорбция р-рителя, однако спецификой Э. является возможность участия
в разл. стадиях процесса частиц, образующихся в результате электрохим.
р-ций с участием р-рителя (напр., в водных р-рах - частиц Надс
и ОНадс). Другая особенность Э.-адсорбция на пов-сти ионов фонового
электролита и ее влияние на электродные р-ции.
 Snадс),
также нередко активируют пов-сть. Модифицирование пов-сти разл. непроводящими
орг. соед., включая металлоорг. комплексы и полимеры, позволяет создавать
системы со специфич. адсорбционными и каталитич. св-вами, обусловленными
в первую очередь функц. группами модификатора. Для таких систем часто используют
назв. "химически модифицированные электроды". Ускорение электрохим. р-ций
в присутствии биол. катализаторов - ферментов - часто наз. биоэлектрокатализом.
Snадс),
также нередко активируют пов-сть. Модифицирование пов-сти разл. непроводящими
орг. соед., включая металлоорг. комплексы и полимеры, позволяет создавать
системы со специфич. адсорбционными и каталитич. св-вами, обусловленными
в первую очередь функц. группами модификатора. Для таких систем часто используют
назв. "химически модифицированные электроды". Ускорение электрохим. р-ций
в присутствии биол. катализаторов - ферментов - часто наз. биоэлектрокатализом.