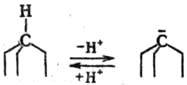Химическая энциклопедия
"РАЦЕМАТЫ"
Главная - Химическая энциклопедия - буква Р - РАЦЕМАТЫ
РАЦЕМАТЫ
, состоят
из эквимол. кол-в энантиомеров и не обладают оптич. активностью" Существуют
в виде мол. соединений (истинные Р.) и рацемич. смесей кристаллич. энантиомеров
(конгломерата, т. е. простой смеси кристаллов право- и левовращающего антиподов)
или смешанных кристаллов, образованных обоими энантиомерами. Физ. св-ва (т-ра
плавления, плотность, р-римость и др.) истинных Р. отличны от св-в индивидуальных
энантиомеров, а их ИК спектры и рентгенограммы отличаются от тех, к-рые дают
простые смеси этих же в-в. Образование истинных Р. обусловлено водородными связями,
индукционным или дисперсионным взаимодействием. Характер связи между энантиомерами
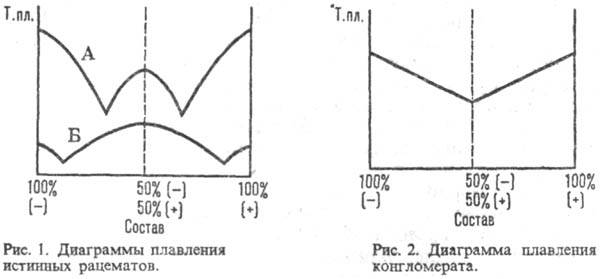
в Р. может быть определен с помощью диаграммы зависимости т-ры плавления от
состава: для истинных Р. (рис. I) она имеет эвтектич. точки и максимум, соответствующий
соотношению энантиомеров 1:1, т-ра плавления м. б. как выше (линия Б), так и
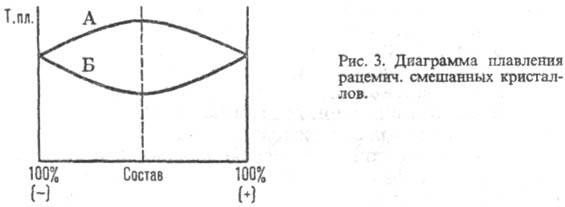
ниже (А) т-р плавления энантиомеров; для конгломерата - резкий минимум в точке
эквивалентности (рис. 2); для смешанных кристаллов диаграмма м. б. выпуклой
(А), вогнутой (Б) или прямой линией (рис. 3). Образование молекулярных
соед. возможно также при смешении энантиомерных форм родственных соед., напр.
(+)-хлорянтарной и (—)-бромянтарной к-т. Подобные раце-мич. соед. наз. квазирацематами.
Их диаграммы плавления сходны с диаграммами истинных Р., но обе половины кривой
состояния уже не симметричны и максимум может и не соответствовать энантиомерному
составу 1:1. Образование квазирацематов используют для определения конфигурации
молекул (метод квазирацематов). Метод заключается в том, что по характеру диаграммы
плавления смеси двух в-в определяют, являются ли они энантиомерами или нет,
и, если конфигурация молекул одного из в-в известна, устанавливают конфигурацию
молекул второго. Об образовании квазирацематов можно судить также по ИК спектрам
и рентгенограммам, к-рые, как и у истинных Р., отличны от спектров и рентгенограмм
простых смесей двух в-в. Р. образуются при любом
хим. синтезе, приводящем к хиральным молекулам, если исходные компоненты р-ции
были оптически неактивны и синтез проводился в отсутствие асимметризующих воздействий
(хиральный катализатор, облучение циркулярно-поляризованным светом и др.; см. Асимметрический синтез
). Это обусловлено тем, что переходные состояния
при образовании энантиомеров энергетически эквивалентны. При наличии асимметризующих
факторов переходные состояния диастереомерны, их энергия различна, поэтому возможно
образование предпочтительно одного из двух энантиомеров конечного продукта. Рацемизация. Р. образуются
также в результате рацемизации оптически активных соед., представляющей собой
обратимое взаимное превращение энантиомеров. В отсутствие асимметризующих факторов
этот процесс заканчивается установлением динамич. равновесия между ними при
строго эквимолярном содержании энантиомеров в смеси. При рацемизации происходит
обмен местами к.-л. двух атомов или радикалов, связанных с элементом хиральности.
Рацемизация - часто не самопроизвольный процесс; она вызывается, напр., действием
к-т, щелочей, повышением т-ры. Скорость и механизм рацемизации
зависят от строения оптически активных соед. и от условий ее проведения (т-ры,
р-рителя, катализатора и т.д.). Кинетически рацемизация обычно описывается ур-нием
для необратимой р-ции первого порядка: k= (2,3/t)lga0/at, где k-константа
скорости рацемизации, a0 и at-величины соотв.
первонач. оптич. вращения и ко времени t. В зависимости от природы элементов
хиральности молекулы энан-тиомера рацемизация м. б. либо химической, либо физической. Хим. рацемизация наиб.
характерна для соед., в молекулах к-рых хиральным центром является асим. атом
углерода. Отрыв от него одного из заместителей приводит к образованию плоского
карбкатиона и потере хиральности. Послед. присоединение этого же заместителя
происходит равновероятно с обеих сторон плоскости карбкатиона, что приводит
к образованию Р. По др. механизму рацемизация протекает с промежут. образованием
карбаниона, напр. в результате отрыва протона от асим. атома С. При термич.
рацемизации в результате гомолитич. разрыва связи асим. атома с одним из заместителей
образуются радикалы, к-рые при рекомбинации дают Р. Легкость протекания рацемизации
зависит от типа функц. групп, связанных с асим. атомом С. Легко рацемизуются
соед., содержащие в качестве заместителей при асим. центре атом водорода и сильный
акцептор электронов, напр, молочная к-та СН3—СНОН—СООН, дикетоны
R—СО— —CHR—COR: и т.д. У дикетонов хиралъность исчезает в результате енолизации.
В то же время соед., не склонные к образованию промежут. ионов или таутомерным
превращениям, напр. алканы, устойчивы к рацемизации. Существуют соед., к-рые
хотя и образуют промежут. ионы, не подвергаются рацемизации, вследствие стерич.
особенностей структуры их молекул. Напр., у производных камфоры или триптицена,
в молекулах к-рых асим. атом С находится в вершине циклич. системы, присоединение
протона к промежут. карбаниону возможно только со стороны, противоположной циклич.
системе: Физ. рацемизацию наиб.
легко проследить на примерах таких родственных соед., как амины, фосфины, арсины,
стибины 3R1R2R3. Молекулы этих соед. имеют
неподеленную пару электронов, и при наличии разл. заместителей у гетероатома
для них возможна оптич. изомерия. Рацемизация знантиомерных форм этих соед.
обусловлена пирамидальной инверсией
. В случае аминов вследствие быстрой
инверсии выделить оптич. изомеры обычно не удается; амины существуют только
в виде Р. Исключения - циклич. соед. (основания Трегера, азиридины, диазиридины)
и третичные амины NR1R2R3, содержащие в радикалах
R элект-роотрицат. заместители. С ростом размера гетероатома в ряду N < Р
< As < Sb величина энергетич. барьера инверсии для соед. 3R1R2R3
возрастает, соотв. увеличивается и устойчивость этих соед. к рацемизации. Стибины
вполне стабильны и при нормальных условиях могут существовать в виде Р. и отдельных
энантиомеров. Без к.-л. хим. р-ций происходит
рацемизация соед. с мол. асимметрией. Такие соед. рацемизуются в результате
взаимного перемещения (гелицены) или вращения (производные дифенила) отдельных
фрагментов их молекул. Если энергетич. барьер этих перемещений достаточно высок,
соед. устойчивы к рацемизации (производные дифенила с четырьмя объемистыми заместителями
в орто
-положениях или гелицены, содержащие в молекуле более шести конденсир.
колец), в случае же малых энергетич. барьеров рацемизация осуществляется достаточно
легко. Расщепление
Р. Обратный рацемизации процесс - выделение энантиомеров из их рацемич.
смеси-наз. расщеплением Р. Впервые расщепление Р. было осуществлено (Л. Пастер,
1848) при кристаллизации натрий-аммониевой соли виноградной к-ты; выделенный
осадок представлял собой энан-тиоморфную смесь кристаллов, а индивидуальные
кристаллы-либо лево-, либо правовращающие формы винной к-ты. Известно лишь неск.
десятков примеров расщепления Р. при спонтанной кристаллизации энантиомеров.
Более общий метод заключается в том, что в пересыщ. р-р Р. вводят затравку кристаллов
одного из энантиомеров, что приводит к кристаллизации именно этого оптич. изомера.
Затем в оставшийся р-р добавляют затравку кристаллов второго энантиомера и тем
самым вызывают его кристаллизацию, поскольку именно этим оптич. изомером пересыщен
оставшийся р-р, и т.д. Расщепление Р. путем затравочной кристаллизации реализовано
в пром-сти (напр., для D,L-глутаминовой к-ты), однако этот способ также не универсален. Др. способ расщепления
Р.-биохимический-основан на том, что микроорганизмы при своем развитии используют
только один из двух оптич. изомеров, присутствующих в Р. Остающийся энантиомер
м. б. выделен. Этот путь позволяет получать только один из энантиомеров, второй
необратимо теряется. Избирательность действия микроорганизмов по отношению к
энантиомерам связана с высокой энантиоселективностью содержащихся в микроорганизмах
ферментов. Поэтому для разделения энантиомеров нет необходимости применять сами
микроорганизмы, достаточно использовать в этих целях выделенные из биол. объектов
ферментные препараты. Наиб. широко для расщепления Р. применяют гидролазы -
ферменты, катализирующие гидролиз сложноэфирных или амидных связей. При этом
гидролизу подвергается только один из двух энантиомеров субстрата, а разделение
конечной смеси, напр., своб. к-ты и ее сложного эфира м. б. легко осуществлено
обычными методами. Так, при действии фермента ацилазы на рацемич. N-ациламинокислоту
гидролизу (а следовательно, и отделению) подвергается лишь L-форма. В то же время высокая специфичность
действия ферментов ограничивает их использование, поскольку мн. синтетические
Р., не встречающиеся в живой природе, не подвергаются воздействию ферментов.
Др. недостаток этого метода-относительно высокая стоимость ферментов. Тем не
менее расщепление Р. с использованием иммобилизованных на нерастворимом носителе
ферментов реализовано в пром. произ-ве оптически активных аминокислот. Наиб. общий метод расщепления
Р.-химический, при к-ром на Р. действуют оптически активным реагентом, в результате
чего образуется новая пара в-в - диастереоме-ров. Последние м. б. разделены
вследствие различия в их физ. св-вах. Хиральный реагент после разделения диасте-реомеров
отщепляют. Напр., рацемич. (R, S)-1-фенилэтил-амин образует с природной
(2R, 3R)-винной к-той две диасте-реомерные соли: [(R)-1-фенилэтиламин]·[(2R,3R)-винная
к-та] и [(S)-1-фенилэтиламин]·[(2R, 3R)-винная к-та], к-рые
обладают разл. р-римостью в этаноле и м. б. разделены кристаллизацией. Своб.
амин выделяют затем экстракцией диэтиловым эфиром из водного щелочного р-ра
соли. Для расщепления рацемич.
к-т используют их способность образовывать соли с хиральными прир. и синтетич.
основаниями-хинином, бруцином, стрихнином, 1-фенилэтилами-ном и др. Рацемич.
спирты расщепляют путем превращения их в кислые эфиры дикарбоновых к-т (напр.,
фталевой) с послед. кристаллизацией в виде диастереомерной соли с хиральным
амином. Метод расщепления Р. путем
превращения их в диастерео-меры не пригоден для орг. соед., не имеющих функц.
групп, напр. для алканов. Для расщепления таких Р. используют, напр., способность
мочевины к образованию клатратов. Мочевина кристаллизуется в хиральной гексагон.
решетке, в цилиндрич. каналах к-рой могут размещаться молекулы "гостя".
Кристаллы мочевины м. б. как право-, так и левовращающими,
поэтому клатраты мочевины с энантиомера-ми приобретают характер диастереомеров.
Разделение Р. по этому способу осуществляют внесением затравки одного из энантиомеров
в насыщ. р-р мочевины и Р., выпадающие при этом кристаллы клатрата обогащены
именно внесенным энантиомером. Др. хим. метод расщепления
Р.-кинетич. расщепление, основанное на том, что в р-циях с оптически активными
реагентами (или в присут. хиральных катализаторов или хиральных р-рителей) скорость
превращения одного энантиомера не равна скорости превращения другого. Если в
подобную р-цию ввести рацемат и прервать р-цию до ее полного завершения, то
один из энантиомеров, реагируя быстрее, будет преобладать в продукте р-ции,
другой-в непрореагировавшем остатке. Пример - расщепление рацемич. (n-толил)
мезитилсульфоксида восстановлением под действием реагента, полученного из оптически
активного 1-фенилэтиламина и А1Н3. Асим. превращениями наз.
процессы, в ходе к-рых происходит превращение Р. в смесь энантиомеров с преобладанием
одного из них. К асим. превращениям относится, в частности, мутаротация
моносахаридов.
Этот метод наз. также ретрорацемизацией. Для расщепления Р. используют
также хроматографию на хиральных неподвижных фазах. Ранее в качестве таких фаз
использовали прир. хиральные полимеры - белки, крахмал, целлюлозу, шерсть и
др., из к-рых теперь применяют только микрокристаллич. целлюлозу и ее производные.
В осн. для расщепления Р. используют более селективные синтетич. хиральные сорбенты,
полученные специально для разделения той или иной группы рацемич. соединений.
Так, Р., молекулы к-рых содержат фрагменты, способные к образованию комплексов
с переносом заряда, м. б. расщеплены на хиральных фазах, имеющих структуру нафтилглицина
(для электроноакцепторных молекул) или динитробензоил-аминокислот и пикрил (1-фенилэтил)
амина (для электроно-донорных молекул). Соед., способные к образованию комплексов
с переходными металлами, м. б. разделены на энантиомеры методом лигандообменной
хроматографии с использованием хиральных комплексообразующих сорбентов. Этим
методом расщепляют, напр., меченные тритием a-аминокислоты. Применяют сорбенты,
содержащие фрагменты циклодекстринов, расщепление Р. на них осуществляется в
результате образования соед. включения. Получены хиральные стационарные фазы,
разделение энантиомеров на к-рых происходит благодаря возникновению водородных
связей и ион-дипольных взаимод. между энантиомерами и сорбентом. Расщепление
Р. хроматографич. методом позволяет одновременно получить и информацию об оптич.
чистоте выделенных энантиомеров. Лит.: Потапов В.М.,
Стереохимия, 2 изд., М., 1988; Jacques J., Collet A., Wilen S.H., Enantiomers,
racemates and resolutions, N. Y., 1981. А. А. Курганов. |
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: РАЦЕМАТЫ
будет выглядеть так: Что такое РАЦЕМАТЫ