Химическая энциклопедия
"РОДИЙ"
Главная - Химическая энциклопедия - буква Р - РОДИЙ
РОДИЙ
(от греч.
rhodon-роза, по розовато-красному цвету его
солей; лат. Rhodium) Rh, хим. элемент VIII гр. периодич. системы,
ат. н. 45, ат. м. 102,9055, относится к платиновым металлам. В природе
один стабильный изотоп 103Rh. Поперечное сечение захвата тепловых
нейтронов 1,56·10-26 м2. Конфигурация внеш. электронных
оболочек атома 4d85s1; степени окисления
0, +1, +2, +3 (наиб. устойчива), +4, + 5, + 6; энергии ионизации Rh0
: Rh+ : Rh2+ : Rh3+
соотв. 7,46, 18,077 и 31,04 эВ; электроотрицательность по Полингу 2,28;
сродство к электрону 1,68 эВ; атомный радиус 0,1342 нм, ионный радиус (координац.
число 6) Rh3+ 0,081 нм, Rh4+ 0,074 нм, Rh5+
0,069 нм. Содержание Р. в земной
коре 1·10-7% по массе. Р. образует твердые р-ры с др. платиновыми
металлами, входит в состав самородной Pt и минералов группы осмистого Ir. В
виде примеси встречается в сернистых, мышьяковистых и сурьмянистых соед. платиновых
металлов, сопутствующих медно-никелевым сульфидным рудам. Содержание Р. в прир.
сырье колеблется от 0,2% (никелевые минералы) до 11,3% (родистый невьянскит). Свойства. Р.-серебристо-белый
металл, кристаллизуется в гранецентрир. кубич. решетке типа Сu, а = 0,3803
нм, z = 4, пространств. группа Fm3m; т. пл. 1963 °С,
т. кип. 3727 °С; плотн. 12,41 г/см3 (20 °С); Стандартные электродные
потенциалы: Сесквиоксид Rh2O3-серые
кристаллы гексагон. синго-нии; при 750 °С переходит в др. модификацию; разлагается
выше 1000 °С на металл и О2; плотн. 8,20 г/см3, Фториды Р. образуются при
фторировании Р. при 500-600°С. Гексафторид RhF6: т. пл. 70°С,
т. кип. 73,5 °С; DHисп 41,8 кДж/моль; неустойчив.
Пентафторид RhF5-темно-красные кристаллы; т. пл. 95,5°С. Трифторид
RhF3-красные кристаллы; возгоняется выше 600 °С; плотн. 5,38
г/см3; не раств. в воде, к-тах и р-рах щелочей. Три-хлорид RhCl3-красные
кристаллы моноклинной сингонии; т. возг. ок. 800 °С, т. разл. 970 °С;
не раств. в воде и к-тах; в солянокислых р-рах существует в виде [RhCl6]3-
или его аквазамещенных; образуется при хлорировании Р. при 250-300 °С, тригидрат
(полиядерное соед. переменного состава)-растворением Rh(OH)3 в соляной
к-те. Сульфиды: Rh2S3 (черные кристаллы ромбич. сингонии,
плотн. 6,40 г/см3 , Комплексы Rh(III) имеют
октаэдрич. конфигурацию, диамагнитны, кинетически инертны в р-циях замещения. Аквакомплекс [Rh(H2O)6]3+
существует в кислых водных р-рах и кристаллич. состоянии в виде [Rh(H2O)6](ClO)3;
рКа1 3,40. Его кислотные св-ва падают при
замещении,воды на др. лиганды, напр. при замещении 5 молекул Н2О
на NH3 рКа 6,80. Комплексы Rh(III) получают из
Na3[RhClj (образуется
по р-ции Комплексы Rh(I) имеют конфигурацию
квадрата, диамагнитны, кинетически лабильны в р-циях замещения, устойчивы в
твердом состояния и неводных р-рах в отсутствие окислителей. Их получают из
карбонилхлорида Rh(I) (оранжево-желтые кристаллы тетрагон. сингонии, т. пл.
123 °С), напр.: [Rh(CO)2Cl],
+ 2L : 2[Rh(CO)2LCl] [Rh(CO)2Cl]2 + 2диен
: [Rh(диен)Сl]2 + 2СО Получены комплексы, где
L-фосфины, арсины, стибины, СО и галогены, алкены, алкины, арены и др. Комплексы
Rh(I) присоединяют малые молекулы (Н2, О2, СО2,
НС1), давая комплексы Rh(III) (окислит. присоединение), могут катализировать
р-ции гомогенного гидрирования и гидро-формилирования орг. соединений. Известны
соед. Rh(I) со связями металл-металл-[N(C2H5)4]4[Rh2X2(SnCl3)4],
где X = Hal-, фосфины, арсины, стибины, арены.
См. также Родийорганические соединения
. Соед. Rh(0)-гoмoядepныe
и гетероядерные кластеры; диамагнитны, устойчивы в твердом состоянии и неводных
р-рах в отсутствие окислителей. Карбонилы получают из безводного RhCl3
и СО при давлении до 20 МПа: при 50-80 °С образуется тетраэдрич. Rh4(CO)12
(красный, т. разл. 150°С), при 80-220 °С-октаэдрич. Rh6(CO)16
(черный, т. разл. 220 °С). Для кластеров Р. характерны след. р-ции: пиролиз
с уменьшением нуклеарности кластерного остова; замещение одного или неск. атомов
каркаса на др. металл; замещение лигандов; конденсация фрагментов кластеров
с увеличением нуклеарности; выключение гетероатома в центр кластерного остова;
восстановление кластера с образованием анионов. Получены кластерные соединения
Р.: [Rh4(СО)12-x{Р(ОРh)3}x где
x=1-4, [Fe2Rh(CO)x] и др. Мономерные комплексы Rh(II)
неустойчивы, парамагнитны. Известны [RhL2Cl]+, [RhL3]2+,
[RhL2(H2O)2]2+, где L-2,2-дипиридил.
Устойчивые соед. Rh(II) димерны, диамагнитны; получают восстановлением [RhCl6]3-
в водно-спиртовых р-рах в присут. карбоновых к-т. Напр., [Rh2(RCO2)4]
имеет структуру "фонарика" с четырьмя мостиковыми лигандами и связью
Rh—Rh; образует аддук-ты [Rh2(RCO2)4X2],
где X = Н2О, пиридин и др. Соединения Р. в степенях
окисления выше + 3 неустойчивы; получены K2[RhF6] (желтый),
Cs2[RhCl6] (зеленый), Cs[RhF6] (темно-красный). Получение. Р. концентрируется
в маточных р-рах после выделения Pt и Pd из солянокислых р-ров, полученных при
переработке сырой Pt или шламов электрохим. рафинирования Си и Ni. Для отделения
неблагородных металлов используют нитрование, при этом хлоридные комплексы Р.
переходят в р-римое соед. Na3[Rh(NO2)6], к-рое
осаждают NH4C1 в виде (NH4)2Na[Rh(NO2)6].
Его переводят в р-р нагреванием с соляной к-той и,восстанавливают муравьиной
к-той до родиевой черни. При нагр. ее в атмосфере Н2 до 1000°С
получают родиевую губку. Аффинаж Р. состоит в переводе
сырой родиевой губки в р-р путем хлорирования, превращении образовавшихся хлоридных
комплексов в одно го след. соед.: [Rh(NH3)5Сl]Сl2,
[Rh(NH3)3Cl3], (NH4)3[Rh(SO3)3],
(NH4)3[RhCl6] с послед. прокаливанием до родиевой
губки. Существуют варианты аффинажа с использованием экстракционных и ионообменных
методов. Чистую родиевую губку переплавляют путем индукц. нагрева в инертной
атмосфере. Применение. Осн. области
применения Р.-произ-во сплавов на основе Pt с содержанием Р. 7, 10, 30% (и более)
для стеклоплавильных аппаратов; изготовление тиглей в произ-ве оптич. стекла
и монокристаллов; нанесение защитных покрытий на электрич. контакты; нанесение
зеркальных покрытий в произ-ве рефлекторов, прожекторов, техн. зеркал, прецизионных
измерит. приборов; получение сплавов с Pt и др. платиновыми металлами-катализаторов
в произ-ве HNO3, а также для дожигания выхлопных газов автомобилей;
изготовление термопар для измерения т-р до 1570 К (Pt-Rh), до 2570 К (Ir-Rh);
изготовление катализаторов р-ции гидроформилирования, гидрирования олефинов
и ацетиленов и др.; ювелирное дело (ограниченно). Р. открыл У. Волластон
в 1804. Лит.: Сплавы благородных
металлов для новой техники, Свердловск, 1983; Мoelwyn-Hughes J. Т., "J.
of the South African Chem. Institute", 1972, v. 25, № 3, p. 155-65; Cole-Hamilton
D.J., "Coordination Chem. Reviews", 1981, v. 35, p. 113-.42; Levason
W., "Ana Repts Progr. Chem.", 1933, sec. A, v. 80, p. 245-75. А. В. Беляев. |
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: РОДИЙ
будет выглядеть так: Что такое РОДИЙ
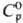 24,95 Дж/(моль · К); DHпл 21,53 кДж/моль,
24,95 Дж/(моль · К); DHпл 21,53 кДж/моль, 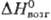 555,9 кДж/моль, DHисп 495,3
кДж/моль;
555,9 кДж/моль, DHисп 495,3
кДж/моль; 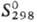 31,48
ДжДмоль·К); температурный коэф.
линейного расширения 8,3·10-6 К-1 (293-373 К); r
4,1 мкОм·см (0°С), 4,33 мкОм·см (20 °С), температурный коэф. r
4,6 · 10-3 К-1 (0-100°С); теплопроводность 150,6
Вт/(м · К); парамагнитен, уд. магн, восприимчивость + 0,99·10-6;
модуль упругости 320 ГПа; для отожженного образца sраст 700
МПа, твердость по Виккерсу 100-120. Отражат. способность пов-сти Р. 80% для
видимой части спектра.
31,48
ДжДмоль·К); температурный коэф.
линейного расширения 8,3·10-6 К-1 (293-373 К); r
4,1 мкОм·см (0°С), 4,33 мкОм·см (20 °С), температурный коэф. r
4,6 · 10-3 К-1 (0-100°С); теплопроводность 150,6
Вт/(м · К); парамагнитен, уд. магн, восприимчивость + 0,99·10-6;
модуль упругости 320 ГПа; для отожженного образца sраст 700
МПа, твердость по Виккерсу 100-120. Отражат. способность пов-сти Р. 80% для
видимой части спектра.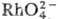 /Rh3+
1,5 В, RhO2+/Rh3+
1,4В, Rh3+/Rh0 0,7В, [RhCl6]2-/[RhCl6]3-1,2
В, [RhCl6]3-/Rh0 0,5 В, [Rh(C14)6]3-/[Rh(CN)6]4-—
0,9 В. Компактный металл при обычных условиях ни с чем не реагирует. Измельченный
Р. медленно окисляется на воздухе при 600 °С, наиб. скорость окисления при
800 °С, при этом образуется Rh2O3. При 100 °С
H2SO4, p-p NaCIO или НВг очень медленно взаимод. с Р.
Расплавл. цианиды (KCN: NaCN = 1:2) при 550 °С реагируют с Р. энергичнее,
чем с др. платиновыми металлами. Р. переходит в р-р после сплавления с KHSO4,
Na2O2 или спекания с ВаО2. Мелкодисперсный
Р., полученный после растворения его сплава с Zn или Cd, способен взрывать на
воздухе. Р. раств. в расплавл. свинце.
/Rh3+
1,5 В, RhO2+/Rh3+
1,4В, Rh3+/Rh0 0,7В, [RhCl6]2-/[RhCl6]3-1,2
В, [RhCl6]3-/Rh0 0,5 В, [Rh(C14)6]3-/[Rh(CN)6]4-—
0,9 В. Компактный металл при обычных условиях ни с чем не реагирует. Измельченный
Р. медленно окисляется на воздухе при 600 °С, наиб. скорость окисления при
800 °С, при этом образуется Rh2O3. При 100 °С
H2SO4, p-p NaCIO или НВг очень медленно взаимод. с Р.
Расплавл. цианиды (KCN: NaCN = 1:2) при 550 °С реагируют с Р. энергичнее,
чем с др. платиновыми металлами. Р. переходит в р-р после сплавления с KHSO4,
Na2O2 или спекания с ВаО2. Мелкодисперсный
Р., полученный после растворения его сплава с Zn или Cd, способен взрывать на
воздухе. Р. раств. в расплавл. свинце.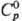 103,7 Дж/(моль · К);
103,7 Дж/(моль · К);
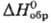 - 355 кДж/моль,
- 355 кДж/моль,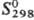 106,2 Дж/(моль·К);
не раств. в воде, к-тах; получают при нагр. на воздухе измельченного Р., его
нитрата или хлорида. Гидроксид Rh(OH)3, или Rh2O3·5H2O,-лимoннo-жeлтый;
разлагается ок. 200 °С; не раств. в воде, гигроскопичен; получают взаимод.
солей Rh(III) со щелочами.
106,2 Дж/(моль·К);
не раств. в воде, к-тах; получают при нагр. на воздухе измельченного Р., его
нитрата или хлорида. Гидроксид Rh(OH)3, или Rh2O3·5H2O,-лимoннo-жeлтый;
разлагается ок. 200 °С; не раств. в воде, гигроскопичен; получают взаимод.
солей Rh(III) со щелочами.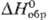 - 242 кДж/моль); Rh2S5 и Rh3S4 (кристаллы,
- 242 кДж/моль); Rh2S5 и Rh3S4 (кристаллы,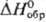 - 318 кДж/моль); Rh9S8 (
- 318 кДж/моль); Rh9S8 (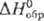 - 640 кДж/моль). Известны и
др. соед. Rh, напр. Rh2P, RhSb, сульфат.
- 640 кДж/моль). Известны и
др. соед. Rh, напр. Rh2P, RhSb, сульфат.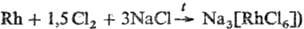 либо
из его водных р-ров, содержащих [RhCl6-x(H2O)x]3-x.
Получены [RhX6-xYx], где X = Hal-,
Y = Н2О, NH3, амины,
либо
из его водных р-ров, содержащих [RhCl6-x(H2O)x]3-x.
Получены [RhX6-xYx], где X = Hal-,
Y = Н2О, NH3, амины,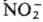 ,
SCN- , N-3,
,
SCN- , N-3,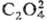 и др. Наиб. легко выделяются соед., содержащие [RhX3Y3],
[RhXY5], [RHX5Y] и [RhX6]. Конц. р-ры галогенидов
Р. содержат полиядерные частицы, в к-рых фрагменты связаны галогенидными мостиками
по ребру октаэдра
и др. Наиб. легко выделяются соед., содержащие [RhX3Y3],
[RhXY5], [RHX5Y] и [RhX6]. Конц. р-ры галогенидов
Р. содержат полиядерные частицы, в к-рых фрагменты связаны галогенидными мостиками
по ребру октаэдра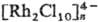 ,
для димеров иногда по грани. В комплексах Rh(III) проявляется статич. и динамич.
трансвлияние лигандов.
,
для димеров иногда по грани. В комплексах Rh(III) проявляется статич. и динамич.
трансвлияние лигандов.