Химическая энциклопедия
"СИММЕТРИЯ МОЛЕКУЛ"
Главная - Химическая энциклопедия - буква С - СИММЕТРИЯ МОЛЕКУЛ
СИММЕТРИЯ МОЛЕКУЛ
, совокупность
операций симметрии, применение к-рых переводит молекулу в физически тождеств.
объект (саму в себя). Операциями С. м. считаются преобразования пространства
и времени, а также перестановки тождеств. частиц. Выполнение операций С. м.
оставляют без изменений ур-ния, выражающие физ. законы; иными словами, эти ур-ния
инвариантны относительно операций симметрии. При последоват. выполнении неск.
операций симметрии инвариантность сохраняется на каждом шаге; операции симметрии
образуют в мат. смысле группу. В частности, физ. законы должны быть сформулированы
так, чтобы они отражали постулируемые на основании опытных данных однородность
и изотропность пространства и неразличимость тождеств. частиц. Операции С. м. В отсутствие
внеш. сил произвольные трансляции (линейные движения в пространстве без вращения)
и повороты молекулы как целого не меняют ее св-в и не меняют вид ур-ний, определяющих
ее поведение; это находит отражение в сохранении полного импульса молекулы и
ее момента импульса. Операциями симметрии молекулы как пространств. тела, совмещающегося
при таких операциях со своей исходной конфигурацией, являются: 1) повороты вокруг
оси симметрии на угол 2pk/n (обозначаются В рамках классич. представлений
о строении молекул св-ва симметрии рассматривают прежде всего для равновесных
конфигураций ядер. Напр., линейная молекула СО2 переходит сама в
себя при любых поворотах вокруг ее оси и при отражении в плоскости, перпендикулярной
этой оси и проходящей через атом С; молекула СН4 имеет симметрию
правильного тетраэдра и т.п. В квантовой механике в наиб. общем смысле С. м.
определяется той группой преобразований, по отношению к к-рым инвариантно ур-ние
Шрёдингера , или в релятивистской квантовой теории-ур-ние Дирака либо уравнение
Брейта-Паули (см. Спин
) и т.п. Каждая группа преобразований носит
назв. группы соответствующего ур-ния (напр., группы ур-ния Шрёдингера ). Эти
группы включают: а) произвольные трансляции и повороты своб. молекулы
как целого; б) инверсию координат всех частиц относительно центра
масс молекулы; в) обращение времени, эквивалентное обращению знака у
всех операторов импульса и момента импульса; г) перестановки тождеств. частиц,
напр. электронов; д) все операции точечной группы симметрии, при
к-рых совмещается сама с собой ядерная конфигурация молекулы. Осн. роль играют
операции, указанные в пунктах г и д, а также инверсия, поскольку
именно они специфичны для каждой конкретной молекулы. Точечные группы С. м.
включают повороты, отражения, зеркальные повороты и инверсию относительно
начала системы координат. Каждая из точечных групп включает и тривиальную (единичную)
операцию, отвечающую отсутствию преобразования пространства. Для каждой точечной
группы симметрии есть хотя бы одна неподвижная при всех операциях этой группы
точка, в качестве к-рой у молекул выступает центр масс. При рассмотрении С. м.
для точечных групп обычно используют обозначения Шёнфлиса . Простейшие точечные
группы включают всего лишь единичную операцию и один нетривиальный элемент симметрии;
ими являются: С2-группа, содержащая вращение вокруг оси второго порядка;
Cs- группа, содержащая отражение в плоскости; Ci-
группа, содержащая инверсию. Более сложными являются группы: Сn,
включающие повороты вокруг оси n-го порядка; Cnu (в
т.ч. С,u), возникающие при расширении групп Сn
операциями отражения su в n плоскостях,
проходящих через ось симметрии Сn (группы симметрии правильных
n-угольных пирамид); Сnh, включающие операции групп
Сп и отражение sh в плоскости, ортогональной
оси симметрии Сn; группы Sn(n = 2k),
состоящие из зеркальных поворотов Sn на угол (p/n)
l, где l = 1, 2,...n; группы Dn, включающие
все повороты, к-рые совмещают правильную n-угольную призму саму с собой;
Dnh-группы симметрии правильной n-угольной призмы,
т.е. расширение групп Dn соответствующими операциями
отражения; группы Dnd-группы симметрии правильных n-угольных
антипризм; Tdt Oh и Ih-группы
симметрии правильных тетраэдра,-октаэдра и икосаэдра соответственно. Эти точечные
группы наиб. часто встречаются при анализе С. м. При рассмотрении кристаллохим.
задач более распространена международная символика точечных групп (или символика
Германа-Могена). В ней плоскость симметрии обозначается буквой m, ось
симметрии-цифрой, указывающей ее порядок; зеркально-поворотная ось-соответствующей
цифрой с чертой над ней, причем в качестве операции зеркального поворота рассматривается
поворот с послед. инверсией (а не отражением в перпендикулярной плоскости, как
то было выше). Кроме того, перпендикулярность оси вращения и плоскости симметрии
отмечается символом дроби "/". Так, группа (4/m)mm,
обозначение к-рой обычно упрощают до 4/mmm, включает повороты вокруг
оси четвертого порядка С4, отражения sh
в плоскости и отражения su и su в двух неэквивалентных плоскостях, т. е. это группа D4h
в обозначениях Шёнфлиса . Все остальные операции, входящие в группу, определяются
как те или иные произведения указанных операций. Группы перестановок
для системы N тождеств. частиц обычно обозначают SN.
Если имеются две подсистемы из N1 и N2
тождеств. частиц (напр., в NH3 подсистемы протонов и электронов),
полной группой перестановок для всей системы будет группа SN1·SN2,
наз. прямым произведением групп и включающая все парные комбинации операций
С. м. для первой и для второй подсистем. Для молекулы, включающей
N тождеств. частиц, возможны N! перестановок частиц, из
к-рых выделяют N(N — 1)/2 простейших, т. наз. транспозиций -перестановок
индексов двух частиц; все остальные перестановки получаются при последоват.
применении неск. транспозиций. Волновая ф-ция молекулы при транспозициях, включающих
помимо пространств. координат частиц их спиновые индексы, либо меняет знак,
если спин частиц полуцелый (т.е. если части-цы фермионы), либо остается без
изменений, если спин частиц целый (т. е. если частицы бозоны). Говорят, что
для системы тождеств. фермионов волновая ф-ция антисимметрична относительно
перестановок (преобразуется по антисимметричному представлению), волновая функция
системы тождеств. бозонов полносимметрична относительно перестановок (преобразуется
по полносимметричному представлению, см. ниже). В качестве примера рассмотрим
симметрию молекулы 12С3Н6. В ней имеются три
подсистемы тождеств. частиц: ядра
углерода 12С (с ядерным спином I = 0), 6 протонов (I
= 1/2) и 24 электрона (со спином s —
1/2). Следовательно, волновая ф-ция
молекулы полносимметрична относительно перестановок индексов ядер 12С
и антисимметрична относительно перестановок индексов как протонов, так и электронов.
С др. стороны, у 12С3D6 волновая ф-ция полносимметрична
относительно перестановок индексов дейтронов (I = 1). При рассмотрении симметрии
ядерной конфигурации и классификации колебательно-вращат. состояний молекулы
важна перестановочно-инверсионная группа, включающая наряду с операциями перестановок
тождеств. частиц также инверсию и все произведения перестановок и инверсии.
Др. словами, перестановочно-инверсионная труппа представляет прямое произведение
групп SN и Сi. Порядок этой группы,
т. е. число содержащихся в ней элементов, м. б, очень большим. Так, для циклопропана
при рассмотрении только лишь подсистемы ядер порядок перестановочно-инверсионной
группы равен: (порядок группы Ci, равный 2) x
(порядок группы S3 для ядер 12С, равный 3!) x
(порядок группы S6 для протонов, равный 6!), т. е. перестановочно-инверсионная
группа включает 2 x 6 x 720 = 8640 операций. Точечные группы С.
м. изоморфны подгруппам соответствующих перестановочно-инверсионных групп, т.е.
между операциями симметрии точечных групп и этих подгрупп существует взаимно
однозначное соответствие. Группы уравнения Шрёдингера .
При выполнении операций этих групп оператор Гамильтона H не меняется.
Отсюда следует, что волновая ф-ция Y при выполнении любой операции Pk
из такой группы переходит в волновую ф-цию PkY,
к-рая также является решением ур-ния Шрёдингера . Следовательно, если нек-рая
группа G включает конечное число операций Pk (k = 1, 2,..., К), то все ф-ции PkY,
наряду с Y, являются решением исходного ур-ния. Для стационарного состояния
мол. системы все эти ф-ции будут соответствовать одной и той же энергии. Если
среди всех ф-ций PkY есть несколько линейно независимых
(напр., Ф1 = Y и Ф2 = PkY),
а все остальные ф-ции РlY (l . k)линейно
выражаются через них, то для описания состояний системы достаточно знать, как
преобразуются при операциях симметрии именно эти независимые ф-ции. Совокупность
преобразований при операциях симметрии линейно независимых волновых ф-ций Фi
(i = 1, 2,..., m) из общего множества К ф-ций PkY
наз. представлением группы. Для того чтобы говорить о преобразованиях волновой
ф-ции Y при операциях С. м., нужно, по существу, сказать о том, как при
этом она переходит в линейные комбинации ф-ций Yi; иными
словами, по какому представлению группы ф-ция Y преобразуется или к какому
типу симметрии она относится. Среди всех возможных представлений каждой конечной
группы всегда можно выделить такие, к к-рым сводятся все остальные представления;
они наз. неприводимыми представлениями. Все волновые ф-ции, являющиеся решениями
ур-ния Шрёдингера , преобразуются по тому или иному неприводимому представлению
группы симметрии этого ур-ния. Симметрия поверхностей
потенциальной энергии (ППЭ). При введении приближений,
позволяющих упростить решение ур-ния Шрёдингера , часто появляются дополнит.
операции С.м., к-рых в исходной, точной постановке задачи не существует. Так,
широко распространено адиабатическое приближение
, согласно к-рому электроны
предполагаются движущимися в фиксир. поле ядер, создаваемом их мгновенной конфигурацией,
тогда как ядра движутся в усредненном по всем конфигурациям электронов потенц.
поле, совпадающем для стационарной задачи с электронной энергией. Электронная
волновая ф-ция Yi(r, R) так же, как и электронная
энергия Ei(R), параметрически зависит от ядерных
переменных R (r-обозначение пространств. переменных электронов),
что позволяет учесть влияние С.м. по отношению, напр., к перестановкам ядер,
на св-ва ф-ций Yi и Ei. Если выбрать к.-л. конфигурацию
ядер и отвечающую ей электронную энергию, то при всех операциях перестановочно-инверсионной
группы, т. е. при всех перестановках тождеств. ядер, напр. протонов в циклопропане,
и при инверсии эта энергия остается без изменений, т. е. ППЭ молекулы симметрична
относительно таких операции. Это утверждение имеет важные следствия. Действительно,
пусть ядерная конфигурация молекулы отвечает нек-рой точечной группе, напр.
D3h. Каждая из операций симметрии меняет местами (переставляет)
тождеств. ядра; это означает, что операции точечной группы эквивалентны нек-рому
подмножеству операций соответствующей группы перестановок, т. е. точечная группа
является подгруппой группы перестановок ур-ния Шредингера. Т. к. при операциях
точечной группы С. м. электронная энергия не меняется, любая точка на ППЭ (в
т. ч. и не отвечающая симметричной конфигурации) переходит, вообще говоря, в
др. точку на ППЭ с той же энергией. В частности, если исходная точка отвечала
минимуму (локальному или глобальному), то и вновь полученная точка также будет
отвечать минимуму. Следовательно, операции симметрии "размножают"
экстремальные и др. особые точки на ППЭ, за исключением тех случаев, когда они
переводят ядерную конфигурацию саму в себя, т. е. когда точка на ППЭ при операциях
С. м. остается неподвижной. Это означает, что ППЭ в целом всегда обладает максимально
допустимой для данной системы ядер симметрией. Так, для ППЭ N2H4
максимально допустимая симметрия D4h (линейные конфигурации
не учитываем, поскольку отвечающие им операции симметрии приводят в осн. лишь
к поворотам системы ядер как целого). В то же время равновесная конфигурация
ядер имеет симметрию точечной группы С2. При этом рассмотрении были
учтены лишь операции симметрии точечных групп, допустимых для конкретных молекул.
В более общем случае необходимо использовать операции симметрии перестановочно-инверсионной
группы либо тех ее подгрупп, которые включают т. наз. физически допустимые операции,
не приводящие, напр., к изменению последовательности хим. связей в молекуле. Др. важное следствие состоит
в том, что точки на ППЭ, отвечающие симметричным ядерным конфигурациям, являются
экстремальными по отношению к несимметричным смещениям ядер. Так, если для молекулы
Н2О с равными межъядерными расстояниями O—H, имеющей симметрию
ядерной конфигурации С2u, произвести смещение ядер О
и H без изменения симметрии, то при операциях точечной группы эта конфигурация
останется без изменений. Если же смещение несимметрично, напр. одна связь О—H
стала длиннее, другая короче, то при операциях симметрии ядерная конфигурация
переходит в другую, но с той же электронной энергией. Уменьшая последовательно
смещение ядер до нуля и каждый раз выполняя одну и ту же операцию симметрии,
получим нек-рую кривую, соединяющую исходные точки, на к-рой лежит и симметричная
конфигурация. Очевидно, что в точке, отвечающей симметричной конфигурации, производная
вдоль этой кривой будет равна нулю, что служит подтверждением высказанного утверждения. При наличии вырождения
ППЭ, к-рое обусловлено С. м. и устраняется при несимметричных искажениях геом.
конфигурации ядер, утверждение об экстремальности симметричных конфигураций
сохраняется, однако при этом отдельные несимметричные конфигурации, "размноженные"
операциями симметрии, будут, вообще говоря, расположены ниже по энергии, чем
исходная симметричная, для к-рой возможно вырождение. Эта ситуация составляет
основу Яна-Тел-лера эффектов. Т. обр., симметричные конфигурации
ядер играют определяющую роль в описании топологии ППЭ молекул. Для Н2О,
напр., возможны симметричные конфигурации ядер, преобразующиеся в себя операциями
точечной группы C2u, и конфигурации симметрии
D,h. Группа C2u является
подгруппой D,h, а остальные операции группы D,h
представляют собой всевозможные повороты вокруг оси С,
и инверсию-отражение
в плоскости, перпендикулярной этой оси, с послед. поворотом на угол p вокруг
С,. Повороты приводят к вращениям всех других (нелинейных)
конфигураций Н2О, а инверсия дополнительно определяет т. наз. четность
вращат. состояния, к-рая связана с тем, меняет или не меняет знак при инверсии
вращат. волновая ф-ция молекулы. В общем случае при вращениях
молекулы как целого каждой конфигурации ядер отвечает эллипсоид инерции, определяющий
эти вращения и обладающий симметрией точечной группы D2h
(либо более высокой, если две или все три оси эллипсоида равны друг
другу). Поэтому вращат. состояния молекул можно классифицировать по неприводимым
представлениям группы D2h. Симметрия равновесной
конфигурации молекулы. Как правило, в хим. приложениях рассматривают равновесные
конфигурации молекул. С ними соотносят все закономерности строения молекул и
на их основе проводят большинство корреляций св-в молекул со строением. Очень
часто, особенно у малых молекул, содержащих атомы элементов 2-го и 3-го периодов
периодич. системы, равновесная конфигурация молекулы в основном электронном
состоянии, отвечающая минимуму на ППЭ, является симметричной. Есть и др. симметричные
ядерные конфигурации, но они отвечают не минимуму, а, напр., максимуму на ППЭ.
Так, у молекулы NH3 возможна, помимо симметрии C3u,
симметрия D3h, когда все 4 ядра лежат в одной плоскости.
Однако такой конфигурации отвечает локальный максимум на сечении ППЭ основного
состояния; отражение в этой плоскости переводит одну равновесную конфигурацию
NH3 в другую, ей эквивалентную. Переход же молекулы из одного минимума
на ППЭ в другой в этом случае носит назв. пирамидальной инверсии. При электронном возбуждении
симметрия равновесной конфигурации может меняться. У аммиака, напр., равновесная
конфигурация ряда возбужденных состояний имеет симметрию D3h;
молекула этилена в основном состоянии плоская, с симметрией D2h,
при возбуждении переходит в состояние с равновесной конфигурацией симметрии
D2d и т. д. Аналогичные изменения симметрии равновесной
конфигурации проявляются и при ионизации молекул. Равновесные конфигурации
молекул могут менять симметрию при переходе в-ва из газовой фазы в конденсированную.
Так, в газовой фазе фенильные кольца бифенила повернуты друг относительно друга
на угол, примерно равный 40°, и молекула имеет симметрию D2,
тогда как в кристалле ее равновесная конфигурация плоская, симметрии D2h.
У молекулы нафталина с симметрией равновесной конфигурации D2h
в газовой фазе при переходе в кристалл симметрия понижается до C2h.
И хотя при этом изменения длин связей (межъядерных расстоянии между соседними
центрами) невелики, все же переход от одного типа С.м. к другому четко проявляется,
напр. в мол. спектрах. Следует отметить, что при
изотопич. замещении атомов в молекуле ППЭ практически не меняется, в силу чего
не меняется и симметрия равновесной конфигурации. Локальная симметрия
отдельных фрагментов молекулы, как и С. м. в целом, определяется теми операциями
точечной группы, к-рые переводят этот фрагмент в себя. Напр., в молекуле метана
(группа Td) операции симметрии, оставляющие на месте
заданный атом водорода, образуют подгруппу С3u группы
тетраэдра, так что локальная симметрия определяется именно этой подгруппой.
Задание локальной симметрии особенно полезно, если можно выделить фрагмент молекулы
без учета его окружения, а влияние окружения рассматривать как малое возмущение.
Так, в толуоле метильный фрагмент имеет ариближенную локальную симметрию С3u,
тогда как реальная симметрия этого фрагмента-Cs. Указание
локальной (точной или приближенной) симметрии позволяет, в частности, дать более
детальную информацию о молекуле. Для В2О3, напр., указание
лишь группы симметрии C2u не позволяет судить
о том, линеен или изогнут фрагмент О—В—О (локальная симметрия соотв.
С,u или С2u), тогда как
запись С2u [В:С2u] говорит
о том, что угол О—В—О отличается от 180°. Симметрия нежестких
молекул. У молекул, имеющих два или более эквивалентных минимума на ППЭ,
разделенных невысокими барьерами, возможен с большой вероятностью относительно
быстрый переход из одного минимума в другой. Операции симметрии, переводящие
одну конфигурацию в эквивалентную ей другую, входят в перестановочно-инверсионную
группу С. м. Эти операции, как правило, можно связать с теми или иными поворотами,
отражениями и инверсией; операции, переводящие исходную конфигурацию нежесткой
молекулы в энергетически ей эквивалентную, носят назв. изодинамич. операций.
Так, для NH3 существует изодинамич. операция sh
- отражение в плоскости, проходящей через центр масс молекулы перпендикулярно
оси 3-го порядка. Если исходную группу С3u дополнить
операцией sh и всеми теми, к-рые получаются при последо-ват.
выполнении операции sh и к.-л. операции из группы С3u,
получится группа D3h. Именно эта группа, являющаяся
прямым произведением групп С3u и Сs и
изоморфная перестановочно-инверсионной группе Сi x S3,
представляет группу симметрии NH3 как нежесткой молекулы
. Для
молекулы С2Н6 возможны повороты вокруг оси С3
не всей молекулы в целом, а одной метальной группы относительно другой. Изодинамич.
операции (вместе с тождеств. операцией) образуют группу. В результате полная
группа С. м. будет состоять из всех произведений операций точечной группы на
операции изодинамич. группы, т.е. является произведением этих двух групп. Для
молекулы CH3BF2 с плоской координацией атомов у атома
В и тетраэдричес-кой у атома С точечной группой симметрии является Cs
или С1, изодинамич. группа, напр. для конфигурации с симметрией
Cs, включает повороты СН3 вокруг оси 3-го порядка, соединяющей
атомы С и В, и повороты BF2 вокруг оси 2-го порядка, совпадающей
с осью 3-го порядка. Поэтому изодинамич. группой в этом случае будет I
= С3 x С2, а полной группой S = (С3
x С2) x Cs. Она является подгруппой
перестановочно-инверсионной группы для молекулы СН3 BF2. Т. обр., для нежестких
молекул, у к-рых допустимы изо-энергетич. переходы из одной конфигурации в другую,
группы симметрии являются более сложными по сравнению с точечными группами,
отвечающими обычным операциям преобразования пространства; в общем случае они,
однако, изоморфны подгруппам перестановочно-инверсионной группы. Орбитальная симметрия.
Симметрия ядерной конфигурации влечет за собой вполне определенное поведение
электронной волновой ф-ции, а именно: при операциях симметрии она преобразуется
по одному из неприводимых представлений группы С. м. В общем случае при представлении
многоэлектронной волновой ф-ции через произведения одноэлектронных ф-ций (орбиталей
)
утверждать что-либо о преобразованиях орбиталей при операциях симметрии
достаточно сложно. Однако в ряде сравнительно простых подходов такие заключения
м. б. сформулированы. Так, если для молекулы с замкнутой оболочкой волновая
ф-ция, записанная в приближении Хартри-Фока, аппроксимирует невырожденное электронное
состояние, мол. орбитали преобразуются каждая по к.-л. из неприводимых представлений
той же группы симметрии, т. е. по тому или иному типу С. м. Из таких мол. орбиталей
можно составлять детерминанты Слейтера или конфигурац. ф-ции состояния заданного
типа симметрии для аппроксимации электронных волновых ф-ций молекулы именно
этого типа симметрии (см. Конфигурационного взаимодействия метод
). Симметрия молекул относительно
обращения времени приводит к детального равновесия принципу
, к-рый
играет важную роль при анализе разл. каналов осуществления хим. р-ции. Этот
принцип утверждает, что вероятность перехода между квантовыми состояниями для
обратного процесса f1 : i1 с
параметрами состояний f1 и i1, отвечающего
обращенному времени, равна вероятности перехода для прямого процесса i :
f. Здесь индексы с цифрой 1 обозначают волновые
ф-ции состояний с заменой времени t на — t (подробнее см. в ст. Динамика элементарного акта
хим. р-ций). Проявления симметрии.
Наличие симметрии ядерной конфигурации отчетливо проявляется во всех св-вах
молекулы. Если ур-ние Шрёдингера имеет группу операций симметрии, не меняющуюся
с течением времени, то волновая ф-ция, являющаяся решением этого ур-ния, сохраняет
свой тип симметрия с течением времени. Для того чтобы тип симметрии волновой
ф-ции изменился, необходимо воздействие возмущения, устраняющего исходную С.
м. Любое воздействие на атом
или молекулу в квантовой механике представляется оператором, к-рый зависит от
переменных частиц, составляющих такую систему, и, следовательно, также может
обладать определенной симметрией. Напр., оператор дипольного момента молекулы
имеет вид: где ri-
радиус-вектор электрона i, Ra-радиус-вектор ядра
а, Za- заряд ядра. При перестановке индексов тождеств.
частиц оператор m не меняется. При инверсии m меняет знак; при поворотах
каждый вектор ri и Ra преобразуется одной
и той же ортогональной матрицей, представляющей данный поворот, и т.д. Теория
групп позволяет определить, будет ли среднее значение оператора или его недиагональный
матричный элемент равен нулю, если известны лишь св-ва симметрии этого оператора
к волновых ф-ций, входящих в выражения для ср. значения или в недиагональный
матричный элемент. Такие утверждения приводят к т. наз. правилам отбора по симметрии.
Напр., квантовые переходы
под влиянием монохроматич. излучения определяются
матричным элементом дипольного момента перехода < F|m|Y >,
равенство нулю к-рого означает нулевую вероятность перехода из состояния Y
в состояние Ф, т.е. запрет на такой переход по симметрии. Спиновые ф-ции для
состояний разл. мультиплетности
обладают разл. перестановочной симметрией,
так что если оператор нек-рой величины не зависит от спиновых переменных, то
переходы, к-рые определяются воздействием, представляемым этим оператором, между
состояниями разной мулътиплетности запрещены. В фотоэлектронных процессах "встряхивания"
вероятность переходов определяется межэлектронным взаи-мод. и пропорциональна
квадрату модуля матричного элемента Весьма существенны требования
симметрии при построении разл. рода корреляц. диаграмм. Так, для двухатомных
молекул при любом межъядерном расстоянии R и, следовательно, при любом
его изменении С. м. сохраняется (группа С,u или
D,u); это означает, что хотя электронная энергия
разных состояний меняется при изменении R, отвечающая каждому
из этих состояний волновая ф-ция сохраняет свой тип симметрии. На корреляц.
диаграмме "электронная энергия - межъядерное расстояние" линии электронной
энергии, начинающиеся от предела "объединенный атом" и кончающиеся
пределом "разъединенные атомы", отвечает обязательно состояниям
одного и того же типа симметрии. К тому же линии, отвечающие состояниям одного
типа симметрии, не пересекаются (правило непересечения). Эти условия -сохранение
типа симметрии и непересечение линий одной и той же симметрии - остаются справедливыми
при нек-рых дополнит. ограничениях и для орбитальных корреляц. диаграмм. Сохранение
симметрии орбиталей важно учитывать при взаимод. молекул, ведущих к хим. р-циям,
если отдельные операции симметрии для системы взаимодействующих молекул сохраняются
при всех расстояниях между молекулами. В этих задачах соблюдаются т. наз. правила
сохранения орбитальной симметрии, налагающие определенные ограничения на возможные
механизмы осуществления
той или иной реакции (см. Вудворда-Хофмана правила
). Нарушения симметрия, как
правило, бывают связаны с тем, что на ППЭ имеются эквивалентные области, переход
между к-рыми затруднен. Это обстоятельство может проявляться по-разному. В качестве
примера рассмотрим ППЭ, на к-рой имеются два эквивалентных минимума, разделенных
достаточно высоким и широким барьером и отвечающих двум оптич. изомерам. Каждый
из изомеров представляет собой нестационарную систему с очень большим временем
жизни; стационарному состоянию системы отвечает равная вероятность нахождения
в обеих потенц. ямах. Др. пример -появление таких нестационарных состояний при
возбуждении. Напр., при фотоионизации молекулы О2 возникает состояние
иона Лит.: Хохштрассер Р., Молекулярные аспекты симметрии, пер. с англ., М., 1968; Каплан И.Г., Симметрия многоэлектронных систем, М., 1969; Болотин А. Б., Степанов Н.Ф., Теория групп и ее применение в квантовой механике молекул, М., 1973; Байкер Ф. Р., Симметрия молекул и молекулярная спектроскопия, пер. с англ., М., 1981; Фларри Р. Л., Группы симметрии. Теория и химические приложения, пер. с англ., М., 1983; Зоркий П.М., Симметрия молекул и кристаллических структур, М., 1986. Н. Ф. Степанов.
|
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: СИММЕТРИЯ МОЛЕКУЛ
будет выглядеть так: Что такое СИММЕТРИЯ МОЛЕКУЛ
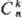 ),
где k и n-целые числа (k
),
где k и n-целые числа (k и);
эта ось наз. осью вращения n-го порядка; 2) отражения в плоскости (обозначаются
s); 3) зеркальные повороты (обозначаются
и);
эта ось наз. осью вращения n-го порядка; 2) отражения в плоскости (обозначаются
s); 3) зеркальные повороты (обозначаются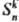 ),
к-рые сводятся к поворотам Ckn и последующему отражению
в плоскости sn, перпендикулярной оси вращения; 4) инверсия
относительно начала системы координат, когда все координаты x, у и
z переходят в — x, — у и — z соотв. (обозначается
i или E*). К. числу операций симметрии относят и тождеств. (тривиальную)
операцию, оставляющую пространств. тело без изменений (обозначается E).
),
к-рые сводятся к поворотам Ckn и последующему отражению
в плоскости sn, перпендикулярной оси вращения; 4) инверсия
относительно начала системы координат, когда все координаты x, у и
z переходят в — x, — у и — z соотв. (обозначается
i или E*). К. числу операций симметрии относят и тождеств. (тривиальную)
операцию, оставляющую пространств. тело без изменений (обозначается E).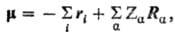
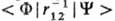 ;
в ряде электромагн. процессов (напр., связанных с вращением плоскости поляризации
светового луча) вероятность переходов определяется матричным элементом магн.
момента системы и т. п.
;
в ряде электромагн. процессов (напр., связанных с вращением плоскости поляризации
светового луча) вероятность переходов определяется матричным элементом магн.
момента системы и т. п.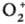 , к-рое формально
отвечает удалению на бесконечность электрона не с мол. орбиталей 1sg
или 1su, а с атомной 1s-орбитали; такие 1s-ионизованные
состояния у обоих ядер нестационарны (как и в случае оптич. изомеров), однако
минимумы на ППЭ разделены очень высоким потенц. барьером, что и ведет к появлению
при ионизации О2 несимметричного состояния-иона
, к-рое формально
отвечает удалению на бесконечность электрона не с мол. орбиталей 1sg
или 1su, а с атомной 1s-орбитали; такие 1s-ионизованные
состояния у обоих ядер нестационарны (как и в случае оптич. изомеров), однако
минимумы на ППЭ разделены очень высоким потенц. барьером, что и ведет к появлению
при ионизации О2 несимметричного состояния-иона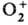 .
Наличие достаточно изолированных, но эквивалентных областей типа потенц. ям
или ложбин приводит и к появлению локальных колебаний, также отвечающих нестационарным
состояниям с большими временами жизни, что позволяет объяснить "несимметричную"
диссоциацию, напр. Н2О : : ОН + Н.
.
Наличие достаточно изолированных, но эквивалентных областей типа потенц. ям
или ложбин приводит и к появлению локальных колебаний, также отвечающих нестационарным
состояниям с большими временами жизни, что позволяет объяснить "несимметричную"
диссоциацию, напр. Н2О : : ОН + Н.